Регуляция активности ферментов путем химической модификации: Реакции ограниченного протеолиза, аденилирования, рибозилирования, ацетилирования, фосфорилирования (роль гормонов, АЦ-комплекса, цАМФ, цГМФ, ионов Ca).
Активность фермента можно изменить путем ковалентной модификации его структуры.
Ковалентная модификация структуры ферментов может быть обратимой и необратимой.
А. Необратимые изменения активности фермента. Существует большое число реакций, катализируемых протеолитическими ферментами. Как правило, такие ферменты образуются в форме неактивных предшественников (проферментов), которые затем активируются путем действия других протеаз. Схеме активирования химотрипсина показана ниже на рис.2-15.
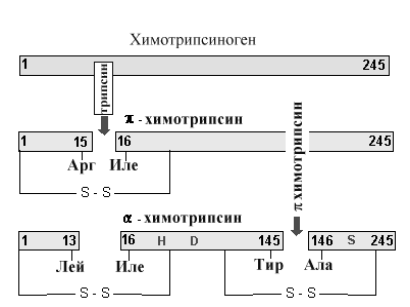 |
Рис 2-15. Схема протеолиза молекулы химотрипсиногена. Вначале под влиянием трипсина происходит отщепление полипептида из 15 аминокислот с образованием активного -химотрипсина, который путем аутокатализа превращается в -химотрипсин
Ниже в таблице приводятся примеры других ферментов, которые подвергаются активируются путем протеолиза
|
|
|
| Фермент | Профермент | Место образования |
| Трипсин | трипсиноген | поджелудочная железа |
| Химотрипсин | химотрипсиноген | поджелудочная железа |
| Эластаза | проэластаза | поджелудочная железа |
| Карбоксипептидаза | прокарбоксипептидаза | поджелудочная железа |
| Фосфолипаза А2 | профосфолипаза А2 | поджелудочная железа |
| Пепсин | пепсиноген | желудок |
| Тромбин | протромбин | свертывание крови |
| C1r | C1r- | комплемент |
| Хитин синтаза | зимоген | стенка клеток дрожжей |
В качестве примера можно рассмотреть ферменты поджелудочной железы. Эти ферменты синтезируются в форме проферментов клетками поджелудочной железы и сохраняются в них в составе гранул проферментов. Высвобождение проферментов регулируется гормонами холецистокинином, панкрезимином и секретином. Усвоение белков требует скоординированного действия различных ферментов. Трипсиноген активируется энтеропептидазой выделяемой клетками щеточной каймы кишечника. Энтеропептидаза катализирует удаление гексапептида (Вал Асп Асп Асп Асп Лиз) от N конца трипсиногена. Задача системы регуляции в данном случае обеспечить активирование фермента в месте его действия. Если активирование произойдет в месте синтеза, то это повлечет за собой разрушение самой железы (острый панкреатит). Небольшое количество энтеропептидазы, необходимое для активирования трипсиногена обеспечит последующее усиление (амплификацию) сигнала за счет образования больших количеств активного трипсина, который в свою очередь активирует другие протеазы кишечника. Такие цепные реакции усиления характерны для многих протеолитических систем организма (свертывание крови, система комплемента и т.д.) Процесс останавливается путем протеолиза самих ферментов Средняя ежедневная продукция короткоживущих гидролитических ферментов поджелудочной железой - около 10 г. Протеолитические ферменты широко распространены в клетках и это могло создать значительные проблемы, если бы не специальные белковые игибиторы, присутствующие в тканях и крови.
|
|
|
Б. Обратимые изменения активности фермента путем ковалентной модификации.
Фосфорилирование ферментов (рис 2-16) - одна из наиболее популярных реакций, позволяющая при присоединении остатка фосфорной кислоты изменить конформацию фермента и перевести фермент из активного состояние в неактивное или наоборот. Этот механизм ковалентной модификации обеспечивается киназами (присоединение остатков фосфорной кислоты за счет АТФ) и фосфатазами (гидролитическое удаление остатков фосфорной кислоты).
Более подробно об этих механизмах будет рассказано в разделах, посвященных механизму действия гормонов.
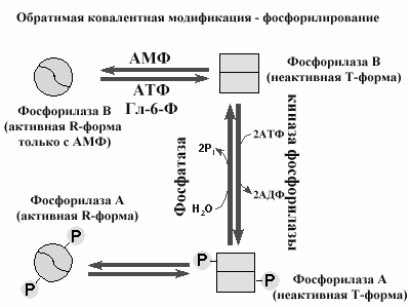 |
Рис 2-16. Обратимая ковалентная модификация путем фосфорилирования (киназа фосфорилазы) и дефосфорилирования (фосфатаза) фосфорилазы.
Гормональная регуляция осуществляется на генетическом уровне путем обратного фосфорилирования. Например под действием адреналина и глюкагона происходит активация процесса распада гликогена, в ходе этого процесса образуется небелковое соединение - цАМФ, цАМФ - внутриклеточный гормон (вторичный посредник) яв-ся аллостерическим регулятором большого числа протеинкиназ. цАМФ образуется из АТФ под действием аденилатциклазы:
Гормон, циркулирующий в крови, попадает в межклеточную жидкость и контактирует с поверхностью клетки, где расположены рецепторы (Rs и Ri), белки узнающие и связывающие гормон.
Гормональный сигнал поступает на АЦ через белки посредники (Gs и Gi), которые активируются в условиях присоединения ГТФ. Уровень, образовавшийся под действием АЦ, цАМФ определяется не только активностью АЦ, но и активностью фосфодиэстераз, которые циклизируют цАМФ до АМФ.
Кроме цАМФ, существуют цГМФ, цУМФ, цЦМФ. Наибольшее значение имеет цГМФ. Она образуется под действием гуанилатциклазы, расположенной как в наружной мембране, так и внутри клетки, цГМФ единственный фермент, который реагирует на концентрацию Н2О2 и активируется под действием продуктов перекисного окисления.
цГМФ оказывает эффекты противоположные цАМФ.
цАМФ находится в тесном контакте с ионами Ca2+: высокая концентрация цАМФ в возбудимых тканях приводит к высокой [Ca2+] и стимуляции клетки. И наоборот, резкое уменьшение [Ca2+] тормозит АЦ и снижает уровень цАМФ.
 2014-02-17
2014-02-17 2668
2668