Взаимодействие Ван-дер-Ваальса
Силы Ван-дер-Ваальса играют большую роль в образовании конденсированных жидких и твердых состояний, во взаимодействиях на поверхности раздела фаз. Ими определяются взаимодействия в газах и возникающие отклонения от законов идеальных газов. В первом приближении эти отклонения подчиняются уравнению Ван-дер-Ваальса для газов:
(Р + a/V2) ∙ (V – b) = ν ∙ R ∙ T, (3.3)
где: a, b – константы, определяющие взаимное притяжение и отталкивание молекул, ν – количество вещества (моль), R – универсальная газовая постоянная, Т – температура. В зависимости от соотношения между давлением (Р) и объемом (V) могут осуществляться различные агрегатные состояния жидкости и газа и переходы между ними.
Биологические макромолекулы также можно рассматривать как конденсированную систему, состояние которой определяется слабыми взаимодействиями. Именно последние и дают основной вклад в стабилизацию конформационного состояния и его изменение в процессе функционирования.
|
|
|
Значение характерной энергии Ван-дер-ваальсовых взаимодействий лежит обычно в пределах 4 – 8 кДж/моль и выше, в то время как тепловая энергия молекулы при комнатной температуре (Т = 300 К) составляет R ∙ T ≈ 48 Дж/моль ∙ град ∙ 300 град ≈ 2,52 кДж/моль, а энергия ковалентной связи 170 – 630 кДж/моль. Силы Ван-дер-Ваальса имеют электромагнитную природу и определяются взаимодействием электрических диполей в соседних молекулах. В зависимости от того, обладают ли взаимодействующие молекулы постоянными электрическими дипольными моментами или эти дипольные моменты возникают вследствие поляризуемости электронных оболочек, существуют различные типы сил Ван-дер-Ваальса.
Рассмотрим взаимодействие двух диполей, ориентированных так, как показано на рис. 3.2.
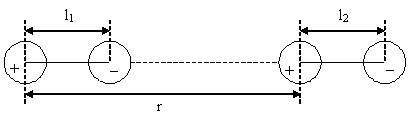
Рис. 3.2. Взаимодействие двух диполей, расположенных вдоль прямой линии (| r | >> l1, l2).
По закону Кулона, энергия ориентационного взаимодействия UОР дипольных моментов Р1 и Р2 равна:
e2 e2 e2 e2
UОР(r) = − ———— − ———— − ———— + ——— (3.4)
r – l1 r + l2 r + l2 – l1 r
и при r >> l1, l2
2 ∙ e2 ∙ l1 ∙ l2 2 ∙ Р1 ∙ Р2
UОР(r) = − —————— = − ——————, (3.5)
r3 r3
где: Р1 = е ∙ l1; Р2 = е ∙ l2; е – заряд электрона; l1, l2 – расстояние между противоположными зарядами. В системе СГСЭ е = 4,8 ∙ 10−10; при l ≈ 10−8 см (длина химической связи) Р ≈ 10−18 или 1D (дебай).
Если диполи свободны и совершают тепловое движение, то в среднем они будут принимать ориентации, соответствующие притяжению, поскольку их собственная энергия (Е) при этом понижается. Вероятность взаимного расположения диполей зависит от их энергии и определяется фактором Больцмана exp (- E / kБ ∙ Т). Усредняя величины Е exp (- E / kБ ∙ Т) по всем ориентациям, при Е << kБ ∙ Т можно найти, что
|
|
|
2 ∙ Р12 ∙ Р22
UОР= − ——————. (3.6)
3 ∙ kБ ∙ Т ∙ r6
 2014-02-18
2014-02-18 1418
1418








