Математическое выражение первого закона термодинамики
Закон утверждает, что в изолированной системе сумма всех видов энергии является величиной постоянной.
. Принимая это во внимание, математическое выражение первого закона термодинамики в дифференциальной форме для 1 кг рабочего тела записывается в следующем виде:
δq= du+ δl.
где q – теплота, сообщаемая рабочему телу, u – внутренняя энергия рабочего тела, l - работа расширения.
Поскольку в правой части математического выражения первого закона термодинамики элементарная работа является неполным дифференциалом, то и элементарная теплота в левой части тоже не может быть полным дифференциалом параметров состояния. Поэтому элементарную теплоту в термодинамике принято также как и элементарную удельную работу обозначать с символом δ.
После интегрирования получим следующее выражение:
Q1,2 = U2- U1 + L1,2.
Здесь для теплоты, также как и для работы нижние индексы 1,2 означают, что теплота является также функцией процесса.
Первый закон термодинамики читается так: подведённая к рабочему телу энергия в виде теплоты расходуется на изменение удельной внутренней энергии тела и на совершение этим телом работы.
Учитывая, что δL = Р dv, можно записать:
δq = du + P dv, [Дж / кг].
Первая форма дифференциального уравнения первого закона термодинамики для одного кг рабочего тела применяется в закрытых системах: цилиндры ДВС, поршневого компрессора.
Имеется ещё несколько формулировок первого закона термодинамики:
1. Энергияне возникает из «ничего» и не уничтожается в «ничто».Тепловая или механическая энергия не могут возникать из ничего или превращаться в ничто.
2. Любая форма движения способна и должна превращаться в любую другую форму энергии.Они могут превращаться взаимно друг в друга только в эквивалентных количествах.
3. Вечный двигатель первого рода невозможен (т. е. нельзя из “ничего” производить работу).
В 1755 году французская Академия наук объявила, что больше не будет принимать к рассмотрению проекты вечных двигателей.
В теплоэнергетике огромное количество процессов подвода теплоты осуществляется для различных рабочих тел в открытых системах при постоянном давлении (в паровых котлах, камерах сгорания газовых турбин и реактивных двигателей, теплообменных аппаратах), а также целый ряд процессов в химических технологиях и многих других. В 19-м веке физик Гиббс ввёл функцию для тепловых расчётов, которую впоследствии назвали энтальпией. Энтальпия используется чаще, чем внутренняя энергия, по этой причине в таблицах термодинамических свойств чаще приводятся значения энтальпии, а не внутренней энергии. Энтальпией обозначается буквой I (или иногда Н) и представляет собой сумму внутренней энергии системы U и произведения давления системы р на ее объем V:
I = U + p•V.
Так как входящие в нее величины являются функциями состояния, то, также как и внутренняя энергия, энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Удельная энтальпия обозначается i (или h), т.е.можно написать
i = u + p•v. [кДж/кг] (3)
Произведение р • v - это работа, которую нужно затратить чтобы ввести газ объемом v в среду с давлением Р,то есть Р • v - это потенциальная энергия газа.
Продифференцируем (3): di = du +P dv + v dP и, учитывая, что
δq = du + р • dv,
запишем:
di = δq + v · dP, (4)
Таким образом, удельная энтальпия больше внешней подведённой теплоты на величину работы v • dP.
 |
Выражение (4) часто записывают:
δq = di - v · dP, (5)
Выражение (5) представляет собой вторую форму записи первого закона термодинамики.
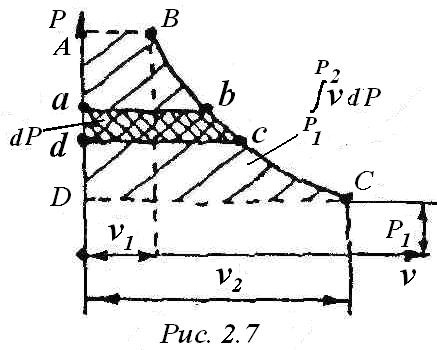
Величина работы v • dP на графике (рис.2.7) представляет собой площадь aв с dа. Из (3) видно, что оба слагаемых правой части полные дифференциалы, следовательно, i- тоже полный дифференциал и энтальпия - функция состояния. Поэтому после интегрирования выражения (4) имеем:
P2
i2 - i1= q1,2 +∫ υ · dP.
P1
Энтальпия также отсчитывается от нуля, за который принимается её значение при температуре 0,01 °С и давление Р = 610,8 Па, а для идеальных газов—при О °С вне зависимости от давления. Так как между энтальпией и внутренней энергией существует вышеприведенная связь, выбор начала отсчета одной из них не произволен: в точке, принятой за начало отсчета внутренней энергии, u = 0, a i = рv. Поэтому, например, для воды при t = 0,01 °С и р= 610,8 Па, и = 0, а i= рv = 610,8∙0.001 = 0,611 Дж/кг.
Дифференциал энтальпии равен
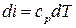 ,
,
где cр – истинная удельная массовая теплоёмкость при постоянном давлении, Т – температура рабочего тела.
В практических расчётах, также как и для внутренней энергии, определяется приращение энтальпии
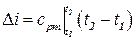
где 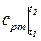 средняя теплоёмкость при постоянном давлении в интервале температур t1 и t2.
средняя теплоёмкость при постоянном давлении в интервале температур t1 и t2.
Размерности внутренней энергии и энтальпии рабочего тела такие же, как и у теплоты и работы – Дж или при отнесении к одному кг рабочего тела – Дж / кг.
 2014-02-09
2014-02-09 3251
3251
