Метод молекулярных орбиталей (Гунд, Малликен, Хюккель, Герцберг) идеологически совпадает с методом Хартри –Фока, первоначально разработанным для атомов.
Каждый электрон имеет свою волновую функцию, имеющую вид произведения пространственной и спиновой функций (спин - орбиталь), полная волновая функция строится в виде детерминанта из одноэлектронных функций.
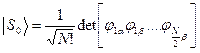 =
=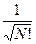
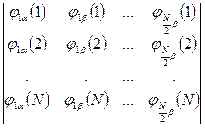 .
.
Тогда уравнение для определения орбиталей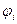 и орбитальных энергий
и орбитальных энергий 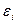 для синглетной конфигурации основного состояния имеет вид:
для синглетной конфигурации основного состояния имеет вид:
[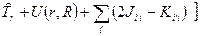
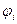 =
=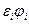
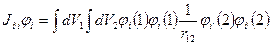
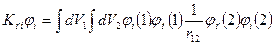
Метод МО: 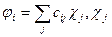 -атомные орбитали. Рутан. Уравнение для коэффициентов разложения.
-атомные орбитали. Рутан. Уравнение для коэффициентов разложения.
Волновые функции возбужденных состояний (конфигураций), возникающих при переходе между орбиталями i и k, тогда имеют вид:
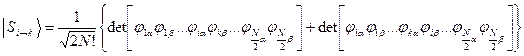
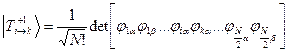
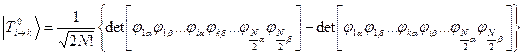
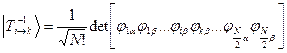
Энергии этих состояний равны
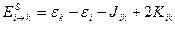
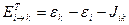
Правило Гунда для одной конфигурации.
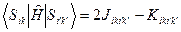
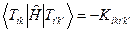
Виды МО: n, π, σ- связывающие π*, σ*- разрыхляющие.
Орбитальные типы состояний nπ*, ππ* σπ*, πσ*,nσ*,σσ*
Sππ*, Tππ* Snπ*, Tnπ*
ΔEππ*(ST) ~0,5-0,7эВ, ΔEnπ*(ST)~0,1-0,2эВ
Зависимость энергии состояний от структуры молекулы.
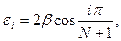
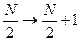 ,
,  ΔEππ *=
ΔEππ *=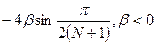
ΔEnπ* =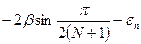
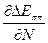 /
/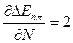
Введение в молекулу электронодонорных заместителей (ОН, NН2) приводит к уменьшению энергии ππ *-состояний и некоторому увеличению энергии nπ*- состояний.
Образование водородной связи приводит к увеличению энергии связи n –электронов и увеличению энергии nπ* -состояний.
Метод ЛО
A-------B, A--------B+, A*-------B, A-------B*
 2014-02-09
2014-02-09 340
340






