В 1940 году академик Н. Н. Семенов опубликовал в журнале "Наука и жизнь" статью "Теория горения". Мы вкратце ознакомимся с разделом этой статьи, посвященным цепным реакциям.
Прямое соединение молекул горючего и кислорода (например, водорода Н2 + О2) является процессом очень затрудненным, потому что хотя вода, например, термодинамически несравненно более устойчива, чем Н2 и О2, но все же относительная устойчивость Н2 и О2 также очень велика. Химический процесс, происходящий между ними, можно уподобить салазкам, стоящим на вершине горы профиля, изображенного на рис. 2.1.
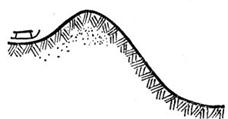
Рис. 2.1. Химический процесс, происходящий между молекулами Н2 и О2, можно уподобить салазкам, стоящим на вершине горы, профиль которой изображен на рисунке.
Гораздо более устойчиво положение салазок у подошвы горы, но, чтобы скатиться вниз, салазки приходится втащить на бугор, затратив предварительно энергию. Поэтому реакция обычно выбирает другой путь, который приводит к большой скорости превращения.
|
|
|
Известно, что свободные атомы, радикалы (*радикалами в химии называют группы атомов, имеющие свободные валентности) и некоторые неустойчивые промежуточные соединения входят с молекулами в реакцию гораздо легче, чем молекулы между собой. При такой реакции наряду с молекулой продукта обычно образуется новый радикал, который в свою очередь реагирует с молекулой, и т. д. При этом один первичный радикал создает длинную цепь последующих реакций. Пользуясь нашей аналогией, мы могли бы сравнить это сгорой профиля, изображенного на рис. 2.2, где в каждой впадине стоят салазки.
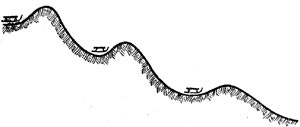
Рис. 2.2. Цепную реакцию можно сравнить со спуском с горы, профиль которой изображен на рисунке, где в каждой впадине стоят салазки.
После того как мы втащили первые из них на бугор и пустили вниз, они ударятся о вторые и столкнут их, вторые столкнут третьи и т. д. Естественно, что такой процесс оказывается гораздо более экономным, чем, если мы будем каждые салазки втаскивать на свой бугор и спускать вниз.
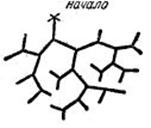
При некоторых условиях при отдельных элементарных реакциях возникают сразу два радикала, что приводит к разветвлению цепи. При этом один первичный центр может вызвать целую лавину химического превращения (см. рис. 2.3., изображающий схематически два типа таких лавин, где каждая черточка изображает один элементарный акт реакции).
| 
|
РЕАКЦИЙ (Из статьи "Теория горения", "Наука и жизнь" №8-9, 1940 г.)
Рис.2.3. Один первичный центр может вызвать целую лавину химического превращения. Изображены два типа таких лавин, где каждая черточка изображает один элементарный акт реакции.
|
|
|
При одних внешних условиях давления, температуры и т. д. эта лавина сможет развиваться, при других нет. Пока нет условий для развития цепной лавины, и при очень редком появлении исходных радикалов, реакция практически не идет вовсе. Как только условия для развития лавины создаются, то сколь бы малое число начальных центров ни создавалось, реакция, лавинообразно ускоряясь, приведет к полному сгоранию вещества. Здесь царит принцип - все или ничего. Либо реакция очень мала, либо она происходит с большой скоростью.
Примеси обрывают цепи и затормаживают процесс горения.
В качестве примера приведем схему реакции окисления водорода (рис. 2.4.).
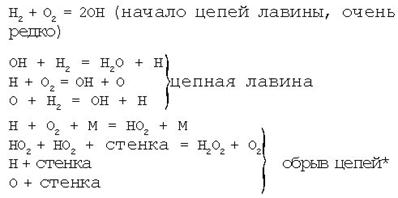
Рис. 2.4. Схема реакции окисления водорода
Уже из этой схемы видно, что примеси в ничтожном количестве могут сильно тормозить реакции, соединяясь с атомами Н, О или с ОН и, тем самым, обрывая цепь.
Пример неразветвленной цепной реакции: водород с хлором образует смесь, взрывающуюся при действии на нее солнечного света. Это объясняется тем, что молекулы хлора, поглощая световую энергию, образуют активные частицы – радикалы, которые мгновенно вступают в реакцию с водородом.
Cl2 + hn ® Cl· +Cl·
Cl· + H2 ® HCl + Н·
Вывод по вопросу: рассмотрен механизм химического взаимодействия при горении. Дано определение энергии активации и зависимость скорости горения от её значения.
Заключительная часть
Вывод по лекции: На лекции рассмотрена физико-химическая природа процессов горения и взрыва, изучен механизм химического взаимодействия при горении. Даны определения процессов горения и взрыва, а также приведена их классификация.
Разъяснение задания на самоподготовку (см. Приложение).
Разработала старший преподаватель кафедры химии, теории горения и взрыва
майор внутренней службы Мочалова Т.А.
(подпись) (должность, фамилия, звание)
”______” _______________ 2013 года
 2014-02-09
2014-02-09 2465
2465