(продолжение)
ДНК-лигаза
В 1961 г. Мезельсон и Вейгл на примере фага λ показали, что рекомбинация (кроссинговер) включает разрыв и последующее воссоединение молекул ДНК. Эта работа дала импульс поиску ферментов, участвующих в процессе рекомбинации. Вскоре при изучении фагов λ и Т4 были выявлены фагоспецифичные нуклеазы, необходимые для осуществления фаговой рекомбинации. Это указывало на правильность предложенной гипотезы о механизме кроссинговера. Начались интенсивные поиски фермента, участвующего в воссоединении расщепленных нуклеазами молекул ДНК, и в 1967 г. независимо в нескольких лабораториях был открыт фермент, катализирующий синтез фосфодиэфирной связи в двухцепочечной ДНК. Он получил название ДНК-лигаза.
При этом удалось обнаружить два типа ДНК-лигаз: фермент, синтезируемый в клетках Е.coli, и фермент, появляющийся в клетках Е.coli, инфицированных фагом Т4. Они различались по потребностям в кофакторах. ДНК-лигаза Е.с. в качестве кофактора требует дифосфопиридиннуклеотид, в то время как лигаза фага Т4 — аденозинтрифосфат (АТР). Кроме того, ДНК-лигаза фага Т4 в отличие от ДНК-лигазы Е.coli способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК ступыми концами, т. е. фрагментов без перекрывающихся одноцепочечных комплементарных участков. Поэтому в настоящее время в генно-инженерных экспериментах предпочитают использовать ДНК-лигазу фага Т4 как более универсальный фермент.
ДНК-лигаза фага Т4 является мономерным полипептидом с молекулярной массой 68 кДа и катализирует образование фосфодиэфирной связи между прилегающими 5'-фосфатным (5'-р) и 3'-гидроксильным (3'-ОН) концами цепей ДНК. При этом возможны два типа реакций.
1. Лигирование липких концов:
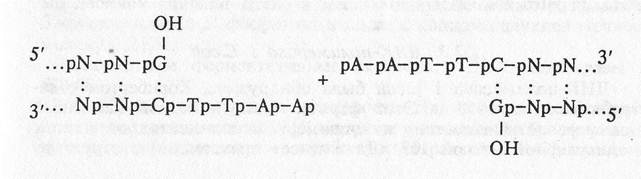
Субстраты этой реакции — двухцепочечные молекулы ДНК с одноцепочечными, полностью комплементарными липкими концами. Частным случаем такой реакции является лигирование так называемого ника (от англ. nick) — разрыва в одной из нитей двухцепочечной ДНК.
2. Лигирование тупых концов:
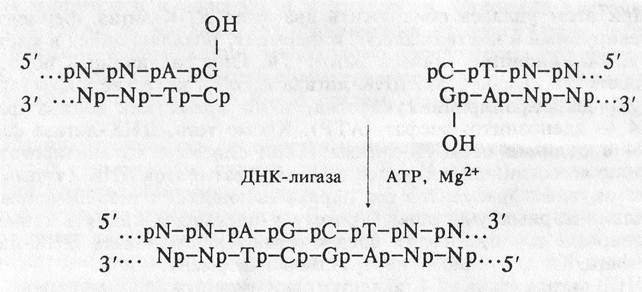
Таким образом, ДНК-лигаза фага Т4 обеспечивает ковалентное соединение любых двухцепочечных фрагментов ДНК, для которых имеется возможность состыковать 5'-р и 3'-ОН концы. Поэтому она является одним из важнейших ферментов, на использовании которых основаны современные методы рекомбинации молекул ДНК in vitro.
ДНК-полимераза 1 Е.coli
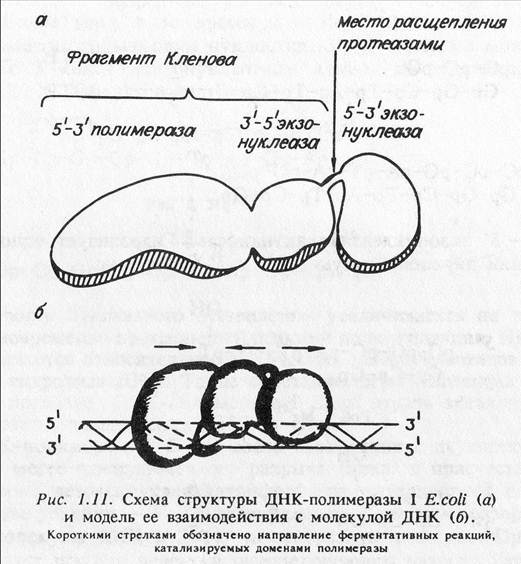
ДНК-полимераза 1 Е.coli была обнаружена Корнбергом с сотрудниками в 1958 г. Этот фермент явился первой найденной полимеразой. Он состоит из мономерной полипептидной цепи с молекулярной массой 103 кДа и имеет трехдоменную структуру. Каждый структурный домен белка обладает отдельной ферментативной активностью: N-концевой домен — 5'-3' экзонуклеаза; С-концевой — 5'-3' полимераза; средний домен 3'-5' экзонуклеаза.
ДНК-полимераза I Е.с. (PolI) не связывается с молекулами двухцепочечной кольцевой ДНК. Однако, если такие молекулы денатурировать и получить одноцепочечные формы, то с последними полимераза связывается в количествах, пропорциональных длине этих участков — примерно одна молекула на 300 нуклеотидных остатков. PolI связывается с одноцепочечными участками двойной спирали ДНК, в местах одноцепочечных разрывов с 3'-гидроксилом и 5'-фосфатом, а также с концами двухцепочечных молекул ДНК.
Рассмотрим ферментативные активности ДНК-полимеразы I Е.coli'.
1. 5'-3' полимеразная активность. Для реакции необходимо наличие одноцепочечной ДНК-матрицы и комплементарного участку этой цепи фрагмента — праймера (затравки) с 3'-ОН концом:
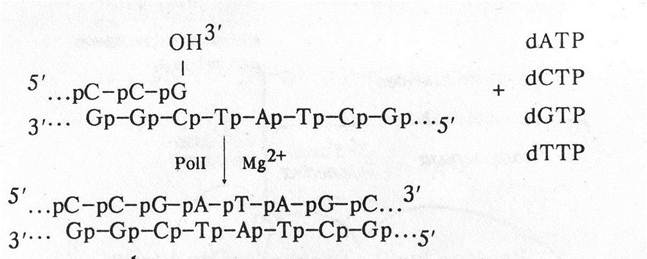
2. 3'-5' экзонуклеазная активность. Гидролизует одноцепочечную или двухцепочечную ДНК с 3'-ОН конца:
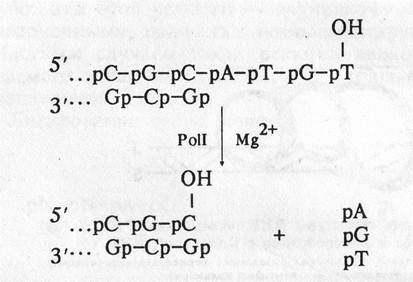
Необходимо подчеркнуть, что 3'-5' нуклеаза расщепляет диэфирную связь только в неспаренных участках ДНК.
Известно, что при полимеразной реакции с определенной частотой возможно включение в растущую цепь некомплементарного нуклеотида. Однако полимераза не может присоединять нуклеотид к неправильно спаренному концу, образовавшемуся при ее участии. На помощь приходит 3'-5' экзонуклеаза, убирающая ошибочный нуклеотид, на место которого затем присоединяется правильный нуклеотид-предшественник. 3'-5' экзонуклеолитическая активность проявляется в направлении, обратном синтезу ДНК (см. Рис. 1.11).
Таким образом, 3'-5' экзонуклеазная активность ДНК-полимеразы играет важную роль в точности полимеризации, направляемой матрицей. Эффективность, или число оборотов, данной экзонуклеазы в оптимальных условиях составляет 2 % от числа оборотов субъединицы с полимеразной активностью.
3. 5'-3' экзонуклеазная активность. Деградирует одну цепь двухцепочечной ДНК, начиная со свободного 5'-конца. В отличие от 3'-5' экзонуклеазы 5'-3' экзонуклеаза расщепляет диэфирную связь только в спаренных участках двухцепочечной молекулы ДНК. Более того, в то время как 3'- 5' нуклеаза отщепляет одномоментно только один нуклеотид, 5'-3' нуклеаза может вырезать с 5'-конца олигонуклеотиды длиной до десяти остатков (около 20 % продуктов гидролиза):
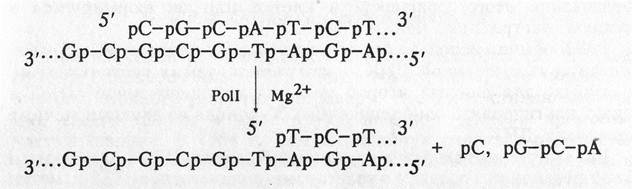
Скорость нуклеазного отщепления увеличивается на порядок при одновременно протекающей реакции полимеризации. При этом увеличивается относительное количество олигонуклеотидов в продуктах гидролиза ДНК. Такое сочетание ферментативных активностей позволяет ДНК-полимеразе 1 Е.coli играть активную роль в репарации повреждений ДНК in vivo.
ДНК-полимераза 1 Е.coli после связывания с двухцепочечной ДНК в месте одноцепочечного разрыва (ника) в присутствии необходимых дезоксинуклеозидтрифосфатов катализирует одновременно две реакции — 5'-3' экзонуклеазный гидролиз разорванной цепи молекулы ДНК и 5'-3' полимеразную реакцию. При этом происходит процесс переноса одноцепочечного разрыва вдоль молекулы ДНК, который иначе называется ник-трансляцией. Заменяя в реакции ник-трансляции нуклеотиды, формирующие цепь ДНК, на радиоактивно-меченые, можно получить меченую ДНК с высокой удельной активностью. Такой методический прием используют довольно часто. Ник в двухцепочечную ДНК обычно вводят, добавляя следовые количества дезоксирибонуклеазы 1 из поджелудочной железы быка. Данный фермент представляет собой эндонуклеазу. В присутствии ионов Mg2+ ДНКаза 1 воздействует независимо на каждую цепь ДНК, при этом места разрывов располагаются случайным образом.
Как уже отмечалось, молекула ДНК-полимеразы 1 Е.coli имеет трехдоменную структуру, причем N-концевой домен соединен с последующим петлей из аминокислотных остатков (см. рис. 1.11), которая наиболее доступна действию протеаз. Поэтому при ограниченном протеолизе фермента субтилизином, трипсином или другими протеазами он распадается на два фрагмента, имеющих размер 68 кДа и 35 кДа. Меньший фрагмент при этом обладает 5'-3' экзонуклеазной активностью, а больший — 5'-3' полимеразной и 3'- 5' экзонуклеазной активностями. Последний бифункциональный фрагмент принято называть фрагментом Кленова ДНК-полимеразы 1 Е.coli (по фамилии одного из авторов, описавших его). Интересно отметить, что фрагмент Кленова ДНК-полимеразы 1 (PolIK) можно выделить и из экстрактов Е.coli. Происходит ли образование этого фрагмента в клетке или он формируется в процессе экстракции, пока не ясно.
PolIK обычно используют для достройки одноцепочечных 5'-концов на двухцепочечной ДНК, часто генерируемых рестриктазами, до тупых; для синтеза второй цепи на одноцепочечной ДНК, а также для гидролиза одноцепочечных 3'-концов на двухцепочечных молекулах ДНК.

Рассмотренные свойства фрагмента Кленова ДНК-полимеразы 1 Е.coli позволили Гоедделу с соавторами предложить в 1980 г. метод репарации, направляемой праймером (primer repair technique). Суть данного подхода заключается в том, что если необходим гидролиз сегмента ДНК с известной последовательностью до строго определенной точки, например до инициаторного ATG-триплета структурного гена, то синтезируется олигонуклеотид-праймер, соответствующий началу этого гена. Затем осуществляют денатурацию сегмента молекулы ДНК, содержащего изучаемый ген, и отжиг в присутствии избытка синтезированного олигонуклеотида. При этом образуются дуплексы между праймером и комплементарной цепью используемого сегмента (рис. 1.12). В процессе обработки фрагментом Кленова ДНК-полимеразы 1 Е.coli одноцепочечный 3'-конец полученного дуплекса удаляется под действием 3'- 5' экзонуклеазной активности, а вторая цепь на 5'-конце достраивается с помощью 5' — 3' полимеразной активности фермента. Данный метод важен для выполнения тонких генно-инженерных манипуляций.
Обратная транскриптаза
При изучении ретровирусов, геном которых представлен молекулами одноцепочечной РНК, было обнаружено, что в процессе внутриклеточного развития ретровирус проходит стадию интеграции своего генома в виде двухцепочечной ДНК в хромосомы клетки-хозяина. В 1964 г. Темин выдвинул гипотезу о существовании вирусспецифичного фермента, способного синтезировать на РНК-матрице комплементарную ДНК. Усилия, направленные на выделение такого фермента, увенчались успехом, и в 1970 г. Темин с Мизутани, а также независимо от них Балтимор открыли искомый фермент в препарате внеклеточных вирионов вируса саркомы Рауса. Данная РНК-зависимая ДНК-полимераза получила название обратная транскриптаза, или ревертаза.
Наиболее детально изучена ревертаза ретровирусов птиц. Каждый вирион содержит около 50 молекул этого фермента. Обратная транскриптаза состоит из двух субъединиц — α (65 кДа) и β (95 кДа), присутствующих в эквимолярном количестве. α-Субьединица представляет собой N-концевую часть (две трети) β-субьединицы.
Обратная транскриптаза обладает, по крайней мере, тремя ферментативными активностями:
1) ДНК-полимеразной, использующей в качестве матрицы как РНК, так и ДНК;
2) активностью РНКазы Н, гидролизующей РНК в составе гибрида РНК – ДНК, но не одно- или двухцепочечную РНК;
3) ДНК-эндонуклеазной активностью.
Первые две активности необходимы для синтеза вирусной ДНК, а эндонуклеаза, по-видимому, важна для интеграции вирусной ДНК в геном клетки-хозяина. β-Субъединица ревертазы обладает всеми тремя активностями, в то время как α-субьединица – только полимеразной и РНКазы Н.
Очищенная обратная транскриптаза синтезирует ДНК как на РНК-, так и на ДНК-матрицах. Чтобы начать синтез, ревертазе, как и другим полимеразам, необходим короткий двухцепочечный участок (праймер). Праймером может служить одноцепочечный сегмент как РНК, так и ДНК, которые в процессе реакции оказываются ковалентно связанными сновосинтезированной цепью ДНК.
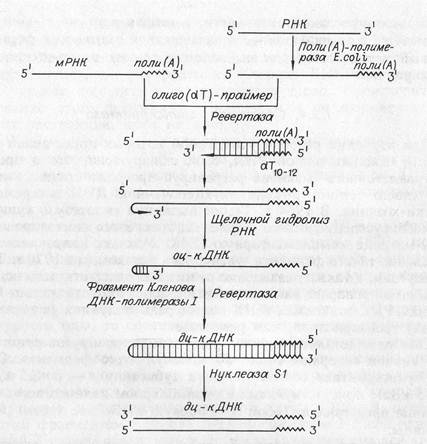
Обратную транскриптазу преимущественно используют для транскрипции матричной РНК в комплементарную ДНК (кДНК). Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. В качестве праймера при обратной транскрипции поли(А)-содержащих мРНК используют олиго(дТ) (рис. 1.13), а для молекул РНК, не имеющих 3'-поли(А)- концов, - химически синтезированные олигонуклеотиды, комплементарные 3'-концу изучаемой РНК. Кроме того, последний тип РНК-молекул можно перевести в поли(А)-содержащие с помощью поли(А)-полимеразы Е.coli.
После синтеза на мРНК комплементарной цепи ДНК и разрушения PHK (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера (см. рис. 1.13). Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как ревертазой, так и ДНК-полимеразой 1 Е.coli. Показано, что сочетание этих двух ферментов позволяет повысить выход полноценных двухцепочечных молекул кДНК.
По окончании синтеза первая и вторая цепи кДНК остаются ковалентно связанными петлей шпильки, служившей праймером при синтезе второй цепи. Эту петлю расщепляют эндонуклеазой Sl, специфически разрушающей одноцепочечные участки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются тупыми, и для повышения эффективности последующего клонирования их репарируют до тупых с помощью фрагмента Кленова ДНК-полимеразы 1 Е. coli. Полученную двухцепочечную кДНК можно затем встраивать в клонирующие векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований.
Нуклеаза Bal31
В 1975 г. Грэй с соавторами, изучая внеклеточные нуклеазы Alteromonas espejiana Ваl31, обнаружили фермент, который функционирует:
1) как экзонуклеаза, катализирующая удаление малых олигонуклеотидов или мононуклеотидов одновременно с 5'- и 3'-концов двухцепочечной ДНК, причем обе цепи ДНК деградируют примерно с одинаковой скоростью;
2) как эндонуклеаза, специфичная к одноцепочечной ДНК.
Данный фермент получил название нуклеаза Ва131.
Способность нуклеазы Ва131 вызывать деградацию с концов одновременно обеих цепей двухцепочечной молекулы ДНК привлекла к этому ферменту в последующие годы большое внимание исследователей. Было показано, что образовавшиеся после обработки Ва131 фрагменты ДНК можно сшить с помощью ДНК-лигазы фага Т4 с другими молекулами ДНК, имеющими тупые концы. Однако эффективность такого лигирования существенно повышается, если укороченные с помощью Bal31 молекулы ДНК обработать фрагментом Кленова ДНК-полимеразы 1 Е.coli. Это указывает на то, что в результате гидролиза нуклеазой Ва131 образуются фрагменты ДНК как с тупыми, так и с одноцепочечными концами.
В определенных условиях линейную двухцепочечную ДНК можно контролируемо гидролизовать с обоих концов нуклеазой Ва131, что в настоящее время активно используется при конструировании гибридных молекул ДНК, когда необходимо в составе этих ДНК сблизить какие-либо функционально значимые генетические элементы.
Концевая дезоксинуклеотидилтрансфераза
В 1962 г. Боллум обнаружил в тимусе теленка необычный фермент, названный концевой дезоксинуклеотидилтрансферазой, или терминальной трансферазой. Данный фермент катализирует последовательное присоединение дезоксинуклеотидов к 3'-ОН концу молекулы ДНК. Субстратом терминальной трансферазы при использовании в качестве кофактора ионов Mg2+ является одноцепочечная ДНК с 3'-ОН концом или двухцепочечная ДНК с выступающим одноцепочечным 3'-ОН концом. При использовании в качестве кофактора ионов Со2+ этот фермент может катализировать присоединение дезоксинуклеотидов к 3'-ОН концу двухцепочечной ДНК с тупыми концами или даже к 3'-ОН концу двухцепочечной ДНК с выступающим одноцепочечным 5'-р концом. При введении в реакцию, направляемую терминальной трансферазой, лишь одного типа дезоксинуклеотидов образуются молекулы ДНК, имеющие гомополимерные одноцепочечные 3'-концы. Таким же образом можно достроить другим молекулам ДНК гомополимерные 3'-концы, комплементарные первым. Смешение полученных препаратов ДНК при определенных условиях может приводить к формированию гибридных молекул ДНК. Именно с помощью концевой дезоксинуклеотидилтрансферазы в 1972 г. был выполнен первый эксперимент по рекомбинации молекул ДНК in vitro.
Поли(А)-полимераза Е.coli
Данный фермент, открытый Сиппелом в 1973 г., катализирует присоединение к свободному 3'-ОН концу одноцепочечных молекул PHK поли (А) –последовательностей.
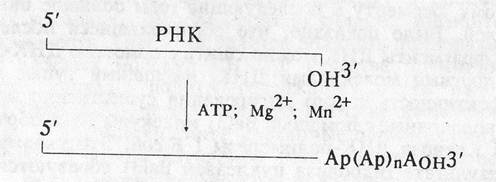
Поли(А)-полимераза находит применение при подготовке молекул PHK к копированию с них комплементарных ДНК (см. рис. 1.13). Кроме того, этот фермент может быть использован для введения радиоактивной метки в 3'-конец PHK.
Кроме рассмотренных выше, в экспериментах по клонированию фрагментов ДНК и анализу структуры гибридных ДНК используют большой набор других ферментов нуклеинового обмена. К ним относятся полинуклеотидкиназа, щелочная фосфатаза, 5'-экзонуклеаза фага А, экзонуклеаза III Е.coli, рибонуклеазы, метилазы и др.
Необходимо подчеркнуть, что все используемые при конструировании гибридных молекул ДНК ферменты должны быть высокоочищенными, так как даже незначительные посторонние нуклеазные загрязнения могут приводить к побочным реакциям и резко снижать эффективность получения целевых генетических конструкций. Поэтому изучение открытых ферментов, разработка методов их глубокой очистки, а также поиск новых ферментов, специфически действующих на нуклеиновые кислоты, активно продолжаются. Важной областью исследований, которой не всегда уделяется должное внимание, является оптимизация условий культивирования микроорганизмов-продуцентов ферментов нуклеинового обмена. В ряде лабораторий показано, что, оптимизируя параметры процесса культивирования путем применения методов математического планирования эксперимента, можно повысить удельный выход этих ферментов в десятки раз.
В совокупности многочисленные ферменты, имеющие в качестве субстрата катализируемых ими реакций нуклеиновые кислоты, составляют биохимическую базу экспериментов по конструированию in vitro и анализу гибридных молекул ДНК.
 2014-02-12
2014-02-12 1471
1471






