Бесцветные прозрачные кристаллы в виде пластинок или белых цилиндрических палочек лучисто-кристаллического строения в изломе, без запаха. Под действием света темнеет, очень легко растворим в воде, трудно растворим в спирте.
Подлинность.
Серебра нитрат дает реакции на катион серебра и нитрат-ион. Официальными реакциями на катион серебра являются следующие:
1. Осаждение раствором кислоты хлористоводородной или раствором натрия хлорида
AgNO3 + NaCl → AgCl↓ + NaNO3
Образующийся осадок серебра хлорида нерастворим в кислоте азотной, но растворим в растворе аммиака с образованием комплекса диамминаргента (1)хлорида
AgCl + 2NH4OН → [Ag(NH3)2]Cl + 2Н2О
2. Реакция «серебряного зеркала», основанная на окислительных свойствах иона серебра (I). При взаимодействии с раствором формальдегида и аммиачной среде на стенках пробирки образуется налет металлического серебра. Реакции идут в следующей последовательности: к раствору серебра нитрата добавляют раствор аммиака до растворения образующегося вначале осадка
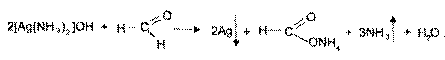
Формальдегид окисляется до муравьиной кислоты, которая в условиях реакции образует аммонийную соль.
3. Нитрат-ион обнаруживают по реакции с раствором дифениламина в кислоте серной концентрированной.
Испытание на чистоту.
1. Недопустимые примеси: соли висмута, меди, свинца, которые могут попасть в лекарственное средство при его недостаточной очистке. Для обнаружения примесей к водному раствору серебра нитрата добавляют избыток раствора аммиака: серебра нитрат образует в этих условиях бесцветный растворимый комплекс
AgNO3 + 2NH4OH → [Ag(NH4)2]NO3 + 2Н2О
Если примеси присутствуют, то они обнаруживаются по следующим эффектам реакций: соли меди по образованию растворимого комплекса синего цвета
CuSO4 + 4NH4OH → [Cu(NH3)4]SO4 + 4Н2О,
если присутствуют соли свинца и висмута, го они в этих условиях образуют осадки гидроксидов и раствор мутнеет
Bi(NO3)3 + 3NH4ОH → Bi(OH)3↓ + 3NH4NO3
Pb(NO3)2 + 2NH4ОH → Pb(OH)2↓ + 2NH4NO3
Согласно требованию ФС, испытуемый раствор должен быть бесцветным и прозрачным.
2. Контролируют кислотность раствора, полученного растворением 1 г серебра нитрата в 10 мл воды. При добавлении к этому раствору 1 капли метилового красного появляется красное окрашивание (кислая реакция среды), переходящее в желтое от добавления 0,1 мл (2 капли) 0,05 моль/л раствора натрия гидроксида (предел кислотности).
Тиоцианатный метод (Аргентометрия, метод Фольгарда), прямое титрование, основан на осаждении труднорастворимого серебра тиоцианата. Среда азотнокислая, индикатор - железоаммониевые квасцы.
НNO3
AgNO3 + NH4SCN → AgSCN↓ + NH4NO3
белый
f = 1
в точке эквивалентности
FeNH4(SO4)2 + 3NH4SCN →Fe(SCN)3 + 2(NH4)2SO4
 2014-02-12
2014-02-12 3265
3265








