Распределение ионов в ДЭС, особенно в его диффузной части, является функцией концентрации электролитов в объеме раствора. Следовательно, концентрация электролита влияет на величину x-потенциала.
По отношению к коллоидным растворам электролиты можно подразделить на индифферентные и неиндифферентные.
В индифферентных электролитах отсутствуют ионы, которые могли бы специфически адсорбироваться на поверхности коллоидных частиц. Неиндифферентные электролиты содержат такие ионы.
Введение в коллоидные растворы индифферентных солей сопровождается двумя явлениями:
1) ионным обменом между противоионами ДЭС и ионами добавленного электролита;
2) сжатием диффузной атмосферы вокруг поверхности частиц.
В качестве примера рассмотрим процессы, происходящие при добавлении раствора NaNO3 к золю AgI с отрицательно заряженными частицами. В таком золе противоионами служат катионы K+. Между введенными ионами Na+ и противоионами ДЭС (K+) происходит ионный обмен. Взаимодействие ионов K+ и Na+ с ионами I‑, являющимися потенциалобразующими, примерно одинаково, поэтому их взаимный обмен подчиняется в основном закону действующих масс. Диффузный слой содержит смесь тех и других ионов.
|
|
|
Однако здесь проявляется и другая сторона действия электролита, поскольку добавка электролита приводит к повышению ионной силы раствора. Согласно теории Дебая—Хюккеля, с повышением ионной силы раствора уменьшается толщина ионной атмосферы и происходит сжатие диффузной части ДЭС. При этом некоторое число противоионов переходит из диффузного слоя в адсорбционный. Следствием такого распределения противоионов является снижение величины x-потенциала (рис. 2 – кривая 1)
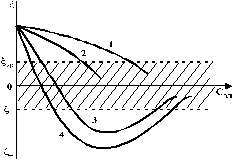
Рис. 2. Зависимость x-потенциала золя от концентрации введенных
электролитов: 1 — NaNO3, 2 — Ca(NO3)2, 3 — Al(NO3)3, 4 — Th(NO3)4;
заштрихованная область отвечает неустойчивому состоянию золя.
Влияние электролитов усиливается, если в их составе имеются многозарядные ионы (Cu2+, Ca2+, Al3+, Th4+). Многозарядные катионы более активно взаимодействуют с отрицательными зарядами (в данном случае с ионами I‑). Вследствие этого такие ионы вытесняют ионы ионы K+ из диффузного и адсорбционного слоев в раствор, становясь на их место. При этом падение ξ-потенциала происходит быстрее, чем при действии однозарядных ионов (рис. 2 – кривая 2).
При добавлении электролитов с ионами, имеющими заряд 3, 4 и более, может происходить не только снижение ξ-потенциала до нулевого значения, но и перемена знака заряда коллоидной частицы (рис. 2 – кривые 3,4). Это явление называют перезарядкой золей. Многозарядные катионы перезаряжают отрицательные золи, а многоосновные анионы - положительные золи. При перезарядке золей ξ-потенциал в какой-то момент времени принимает нулевое значение, при этом общий заряд коллоидной частицы тоже близок к нулю. В этом случае говорят, что коллоидная частица находится в изоэлектрическом состоянии. Явление перезарядки возникает из-за сверхэквивалентной адсорбции многозарядных ионов
|
|
|
 2014-02-13
2014-02-13 4815
4815








