Электролизом называют процессы, протекающие под действием электрического тока на электродах, погруженных в расплав или раствор электролита. При электролизе происходит превращение электрической энергии в химическую.
При электролизе расплава соли или щелочи на катоде всегда восстанавливаются катионы металла, а на аноде окисляются анионы кислотного остатка (электролиз расплавов солей) или гидроксид – анионы (электролиз расплавов щелочей).
Пример 1. Составьте электронные уравнения процессов, происходящих на электродах при электролизе расплава щелочи гидроксида натрия.
Решение. При плавлении происходит термическая диссоциация щелочи:
NaOH ® Na+ + OH-
Под действием электрического тока происходит направленное движение ионов. На катоде будет идти восстановление катионов Na+, на аноде – окисление гидроксид –анионов:
(-) Катод Na+ OH- ® Анод (+)
Na+ + 1e ® Na 4ОН- - 4е ® 2Н2О + О2
 Суммарное уравнение:
Суммарное уравнение:
Na+ + 1ē ® Na 4
4ОН- - 4ē ® 2Н2О + О2 1
 4Na+ + 4OH- ® 4Na + 2H2O + O2
4Na+ + 4OH- ® 4Na + 2H2O + O2
Молекулярное уравнение:
4NaOH 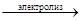 4Na + O2 + 2H2O
4Na + O2 + 2H2O
|
|
|
В водных растворах электролитов находятся гидратированные ионы растворенного вещества и молекулы воды. При электролизе растворов наряду с процессами восстановления катионов и окисления анионов вещества на электродах, могут восстанавливаться или окисляться и молекулы воды.
На катоде протекает процесс восстановления. В зависимости от величин стандартных электродных потенциалов металлов (табл. 6) возможны три варианта катодного процесса при электролизе.
1.Если соль образована катионами металлов, расположенными в раду стандартных электродных потенциалов от Li+ до Al3+ включительно, то на катоде происходит электрохимическое восстановление молекул воды с выделением водорода:
2Н2О + 2ē ® Н2 + 2ОН-
2.Если соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после водорода, на катоде восстанавливаются катионы этих металлов:
Меn+ + nē ® Ме
3.Если соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после Al3+ до водорода, то на катоде восстанавливаются катионы металлов одновременно с молекулами воды:
Меn+ + nē ® Ме
2Н2О + 2ē ® Н2 + 2ОН-
На аноде протекает процесс окисления. Характер реакций, протекающих на аноде, зависит от природы электролита, присутствия молекул воды и материала анода. Аноды подразделяются на нерастворимые и растворимые.
В случае нерастворимых (инертных) анодов возможны два варианта анодного процесса при электролизе.
1.Если соль образована бескислородной кислотой (кроме фторидов), то на аноде окисляются анионы этих кислот, например:
|
|
|
2J- - 2ē ® J2
или S2- - 2ē ® S
2.Если соль образована кислородсодержащей кислотой, то на аноде окисляются молекулы воды с выделением О2:
2Н2О – 4ē ® О2 + 4Н+
Если электролизу подвергается раствор щелочи, то на аноде будут окисляться гидроксид – ионы:
4ОН- - 4ē ® О2 + 2Н2О
В случае растворимых (активных) анодов сам анод подвергается окислению:
Ме Û Меn+ + nē
металл уходят уходят
анода в раствор во внешнюю цепь
Образующиеся катионы переходят в раствор, анод при этом растворяется.
Пример 2. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора хлорида натрия NaCl с нерастворимым анодом.
Решение. Натрий располагается в начале ряда стандартных электродных потенциалов до алюминия и на катоде будут восстанавливаться молекулы воды. На аноде будут окисляться хлорид – ионы, так как это анионы бескислородной кислоты:
NaCl ® Na+ + Cl-
(-) Катод Na+ Cl- ® Анод (+)
Н2О
2Н2О + 2ē ® Н2 + 2ОН- 2Cl- -2ē ® Cl2
Суммарное уравнение:
2Н2О + 2ē ® Н2 + 2ОН-
 2Cl- -2ē ® Cl2
2Cl- -2ē ® Cl2
2Н2О + 2Cl- ® Н2 + 2ОН- + Cl2
В прикатодном пространстве накапливаются катионы Na+ и анионы ОН-, образуя щелочь NaOH.
Молекулярное уравнение:
2NaCl + 2H2O 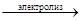 H2 + Cl2 + 2NaOH
H2 + Cl2 + 2NaOH
катод анод в прикатодном
пространстве
Пример 3. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Ag2SO4. Сколько граммов серебра выделится на катоде при электролизе раствора Ag2SO4 в течение 60 минут при силе тока 4А? Чему равен объем газа, выделившегося на аноде?
Решение. Серебро располагается в ряду стандартных электродных потенциалов после водорода, следовательно, на катоде будет идти восстановление катионов серебра. На аноде идет окисление молекул воды с выделением кислорода, т.к. соль образована кислородосодержащей кислотой.
Ag2SO4 ® 2 Ag+ + SO42 -
(-) Катод 2 Ag+ SO42 - ® Анод (+)
Н2О
2Ag+ + 2ē ® 2Ag 2H2O - 4ē ® O2 + 4H+
В прианодном пространстве накапливаются ионы SO42 - и Н+, образуя кислоту Н2SO4.
Суммарное уравнение:
 2Ag+ + 2ē = 2Ag 2
2Ag+ + 2ē = 2Ag 2
2H2O - 4ē = O2 + 4H+ 1
 4Ag+ + 2H2O = 4Ag + O2 + 4H+
4Ag+ + 2H2O = 4Ag + O2 + 4H+
или
2Ag2SO4 + 2Н2О 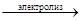 4Ag + О2 + 2Н2SO4
4Ag + О2 + 2Н2SO4
катод анод в прианодном
пространстве
По законам Фарадея масса выделившихся на электродах веществ (m) определяется по формуле:
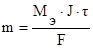 ,
,
где Мэ – молярная масса эквивалента вещества, г/моль;
J – сила тока, А;
t - продолжительность электролиза, с;
F – число Фарадея (96500 Кл).
Молярная масса эквивалента серебра в Ag2SO4 равна отношению молярной массы серебра к его валентности:
Мэ(Ag) = МAg/1 = 107,87 г/моль.
Подставив в формулу значения Мэ(Ag) = 107,87 г/моль, J = 4А,
t = 60 × 60 = 3600 с, получим:
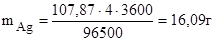 .
.
При определении объемов выделившихся газов закон Фарадея имеет вид:
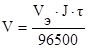 ,
,
где V – объем выделившегося газа, л;
Vэ – молярный объем эквивалента газа, л.
Молярная масса кислорода М 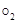 = 32 г/моль, молярная масса эквивалента кислорода М
= 32 г/моль, молярная масса эквивалента кислорода М 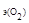 = 8 г/моль. Молярный объем эквивалента кислорода рассчитываем, исходя из следствия закона Авогадро:
= 8 г/моль. Молярный объем эквивалента кислорода рассчитываем, исходя из следствия закона Авогадро:
32 г кислорода при н.у. занимают объем 22,4 л
8 г кислорода при н.у. занимают объем х л (Vэ)
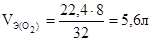 , тогда объем кислорода, выделившегося на аноде, будет равен:
, тогда объем кислорода, выделившегося на аноде, будет равен:
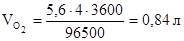 .
.
Пример 4. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Ni(NO3)2. Вычислите продолжительность электролиза, если при силе тока 3А на катоде выделилось 5,8 г никеля.
Решение. Никель располагается в ряду стандартных электродных потенциалов после алюминия, но до водорода. На катоде будет происходить восстановление катионов никеля, а также молекул воды с выделением водорода. На аноде идет окисление молекул воды с выделением кислорода.
Ni(NO3)2 ® Ni2+ + 2NO3-
(-) Катод Ni2+ 2NO3- ® Анод (+)
Н2О
Ni2+ + 2ē ® Ni0
2Н2О + 2ē ® Н20 + 2ОН- 2Н2О - 4ē ® О2 + 4Н+
В прианодном пространстве накапливаются ионы NO3 - и Н+, образуя кислоту НNO3.
Суммарное уравнение
Ni2+ + 2ē ® Ni0


 2Н2О + 2ē ® Н20 + 2ОН-
2Н2О + 2ē ® Н20 + 2ОН-
2Н2О - 4ē ® О2 + 4Н+ ® 2Н2О + 2Н+
|
|
|
 | |||
 |
Ni2+ +2Н2О = Ni + Н2 + О2 + 2Н+
или
Ni(NO3)2 + 2Н2О 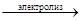 Ni + Н2 + О2 + 2НNO3
Ni + Н2 + О2 + 2НNO3
катод анод в прианодном
пространстве
Для вычисления времени электролиза используем математическое выражение законов Фарадея:
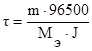 .
.
Молярная масса эквивалента никеля в Ni(NO3)2 равна отношению молярной массы никеля к его валентности: Мэ(Ni) = 58,71/2 = 29,35 г/моль.
Продолжительность электролиза:
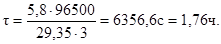
Пример 5. На сколько граммов уменьшится масса висмутового анода, если электролиз раствора BiCl3 проходит при силе тока 2А в течение
40 минут? Составьте схему электролиза.
Решение. Процесс электролиза с растворимым анодом сводится к окислению атомов материала анода и восстановлению на катоде катионов висмута из раствора, т.е. к переносу висмута с анода на катод. Анод растворяется, при этом количество ионов висмута Bi3+ в растворе остается неизменным.
BiCl3 ® Bi3+ + 3Cl -
(-) Катод Bi3+ 3Cl - ® Анод (+)
висмутовый

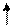 Bi3+ + 3ē ® Bi0 Bi0 - 3ē ® Bi3+
Bi3+ + 3ē ® Bi0 Bi0 - 3ē ® Bi3+
 |
Процесс будет продолжаться до полного растворения анода.
По законам Фарадея рассчитаем массу выделившегося на катоде висмута:
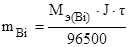 , где J = 2А, t = 40 × 60 = 2400 с.
, где J = 2А, t = 40 × 60 = 2400 с.
Молярная масса эквивалента висмута в BiCl3 равна отношению молярной массы висмута к его валентности:
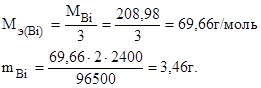
Следовательно, масса висмутового анода уменьшилась на 3,46 г.
ЗАДАНИЯ
261.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН и расплава КОН. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора КОН в течение 1ч при силе тока 6А.
262.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов CuSO4 и КJ. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора CuSO4 в течение 30 мин при силе тока 4А.
263.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов Na2SO4 и HgCl2. Сколько граммов воды разлагается при электролизе раствора Na2SO4 при силе тока 7А в течение 5 ч?
264.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов К2SO4 и CuCl2. Вычислите объем выделившихся на электродах веществ, если электролиз К2SO4 проводили при силе тока 5А в течение 3ч.
|
|
|
265.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgCl2 и NiSO4. Вычислите продолжительность электролиза раствора NiSO4 в минутах, если при силе тока 8А на катоде выделилось 1,8г никеля.
266.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора CuCl2: а) если анод медный; б) если анод инертный. Вычислите количество выделившейся меди на катоде, если электролиз CuCl2 с инертным анодом проводили в течение 5 часов при силе тока 5А.
267.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов CuSO4 и КCl. Вычислите, сколько граммов меди выделилось на катоде, если при электролизе раствора CuSO4 на аноде выделилось 168 мл кислорода, измеренного при н.у.
268.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов Zn(NO3)2 и NaBr. Вычислите силу тока, если электролиз раствора нитрата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода, измеренного при н.у.
269.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора ZnSO4: а) в случае инертного анода; б) в случае цинкового анода. Вычислите, на сколько граммов уменьшится масса цинкового анода, если электролиз раствора ZnSO4 происходит при силе тока 2А в течение 40 мин.
270.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов NaJ и CdSO4. Вычислите, какие вещества и в каком количестве выделятся при электролизе раствора NaJ в течение 2,5 ч, если сила тока равна 6А.
271.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора NiCl2, если анод сделан из никеля, и раствора AgNO3, если анод инертный. Как изменится масса никелевого анода после пропускания тока силой 3,2А в течение 30 мин?
272.Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе расплава NaCl и водного раствора NaCl. Сколько литров (н.у.) газа выделится на аноде при электролизе раствора хлорида натрия, если электролиз проводить в течение 30 мин при силе тока 0,5А?
273.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4 и ZnCl2. Вычислите силу тока при электролизе раствора MgSO4 в течение 1 ч 40 мин, если на катоде выделилось 1,4 л водорода (н.у.).
274.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом; с растворимым - серебряным анодом. Вычислите массу серебра и объем кислорода, выделившихся на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом, если время электролиза 50 мин, сила тока 2А.
275.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов CdCl2 и Na2CO3. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора карбоната натрия в течение 180 мин при силе тока 5А.
276.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов KNO3 и CuBr2. Электролиз раствора KNO3 проводили в течение 5 ч при силе тока 7А. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде.
277.Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов KBr и Hg(NO3)2. Какие вещества и в каком количестве выделяются на инертных электродах при электролизе водного раствора KBr в течение 1 ч 35 мин при силе тока 15 А?
278.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора KCl и расплава KCl. Вычислите количество выделившихся продуктов на катоде и на аноде при электролизе раствора KCl в течение 60 мин при силе тока 5 А.
279.Составьте электронные уравнения процессов, происходящих на электродах при электролизе водных растворов AgNO3 и FeCl2. Электролиз раствора AgNO3 проводили при силе тока 2 А в течение 4 часов. Сколько граммов серебра выделилось на катоде?
280.Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора FeSO4, с нерастворимым анодом и с растворимым – железным анодом. Вычислите продолжительность (в мин) электролиза раствора FeSO4 с нерастворимым анодом при силе тока 10А, если на катоде выделилось 6,8 г железа.
 2015-01-30
2015-01-30 7913
7913
