Окислительно-восстановительными реакциями называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ.
Под степенью окисления понимают тот условный заряд атома, который вычисляется исходя из предположения, что молекула состоит только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые ставятся над символом элемента:  .
.
Степень окисления элементов в простых веществах равна нулю 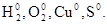
Водород в соединениях проявляет степень окисления +1, за исключением гидридов щелочных и щелочноземельных металлов 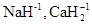 , где его степень окисления –1.
, где его степень окисления –1.
Кислород в соединениях проявляет степень окисления –2, за исключением пероксидов 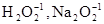 , где его степень окисления –1, или в соединении с фтором
, где его степень окисления –1, или в соединении с фтором 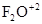 , где степень окисления кислорода +2.
, где степень окисления кислорода +2.
Степень окисления элементов можно определить исходя из положения элемента в периодической системе Д.И.Менделеева (см. раздел «Периодическая система элементов Д.И.Менделеева», пример 2).
|
|
|
В молекулах сложных веществ неизвестную степень окисления элемента определяют исходя из электронейтральности молекулы, используя правило: алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, а в сложном ионе - заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия 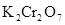 . Степень окисления калия +1, кислорода –2. Степень окисления хрома обозначим через х:
. Степень окисления калия +1, кислорода –2. Степень окисления хрома обозначим через х: 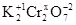 . Исходя из электронейтральности и с учетом числа атомов получаем уравнение: (+1)×2 + 2х + (-2)×7 = 0; х = +6.
. Исходя из электронейтральности и с учетом числа атомов получаем уравнение: (+1)×2 + 2х + (-2)×7 = 0; х = +6.
Степень окисления хрома равна +6.
Аналогично вычисляем степень окисления марганца в ионе MnO 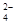 :
:
х + (-2) × 4 = -2, х = +6.
В окислительно-восстановительных реакциях происходит перемещение электронов от одних атомов или ионов к другим. При этом протекают два взаимосвязанных процесса – окисление и восстановление.
Окисление – процесс отдачи электронов молекулой, атомом или ионом. Степень окисления при этом повышается
H 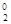 - 2ē ® 2H
- 2ē ® 2H 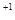 , Al
, Al 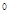 - 3ē ® Al
- 3ē ® Al 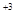 , S
, S 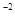 - 6ē ® S
- 6ē ® S 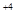 .
.
Восстановление – процесс присоединения электронов молекулой, атомом или ионом. Степень окисления при этом понижается.
Cl 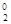 + 2ē ® 2Cl
+ 2ē ® 2Cl 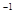 , S
, S 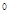 + 2ē ® S
+ 2ē ® S 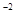 , N
, N 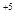 + 8ē ® N
+ 8ē ® N 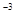 .
.
Вещества, атомы или ионы которых, отдают электроны, называются восстановителями. В процессе реакции восстановители окисляются, образуя продукты окисления.
Вещества, атомы или ионы которых присоединяют электроны, называются окислителями. В процессе реакции окислители восстанавливаются, образуя продукты восстановления.
Пример 1. Определите среди приведенных реакций реакцию обмена и окислительно-восстановительные реакции и расставьте коэффициенты в уравнениях реакций.
|
|
|
а) 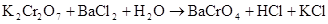
б) 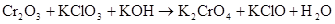
в) 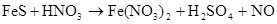
Решение. В отличие от окислительно-восстановительных реакции обмена не сопровождаются изменением степени окисления атомов элементов реагирующих веществ. Определим степени окисления атомов всех элементов в каждой реакции.
а) 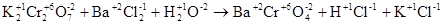
В данной реакции степени окисления атомов элементов не изменяются, реакция не окислительно-восстановительная. Реакция относится к реакциям обмена, в результате ее протекания образуется малорастворимое соединение 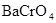 . Находим коэффициенты в уравнении методом подбора, подсчитывая баланс элементов в левой и правой части уравнения в следующей последовательности: калий, хром, барий, хлор, водород, кислород.
. Находим коэффициенты в уравнении методом подбора, подсчитывая баланс элементов в левой и правой части уравнения в следующей последовательности: калий, хром, барий, хлор, водород, кислород.
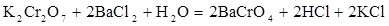
Полное ионно-молекулярное уравнение реакции обмена:

Ионно-молекулярное уравнение в сокращенной форме:
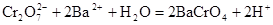
б) 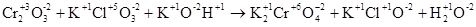
В данной реакции меняют степень окисления атомы хрома и хлора, реакция относится к окислительно-восстановительной. Уравниваем реакцию методом электронного баланса с помощью электронных уравнений, в которых указываются изменения степени окисления атомов элементов и число электронов, отданных восстановителем и принятых окислителем.
Степень окисления хрома повышается от +3 до +6, хлора понижается от +5 до +1, следовательно 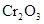 - восстановитель,
- восстановитель, 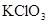 - окислитель.
- окислитель.


 При составлении электронных уравнений следует исходить из числа атомов элементов, изменивших степень окисления у восстановителя и окислителя. В молекулу восстановителя входят два атома хрома, в молекулу окислителя один атом хлора. Число атомов каждого элемента слева и справа в электронном уравнении должно быть одинаково, следовательно, электронные уравнения имеют следующий вид:
При составлении электронных уравнений следует исходить из числа атомов элементов, изменивших степень окисления у восстановителя и окислителя. В молекулу восстановителя входят два атома хрома, в молекулу окислителя один атом хлора. Число атомов каждого элемента слева и справа в электронном уравнении должно быть одинаково, следовательно, электронные уравнения имеют следующий вид:
2Cr 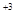 - 2×3ē ® 2Cr
- 2×3ē ® 2Cr 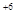 6 2 окисление
6 2 окисление
Cl 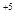 + 4ē ® Cl
+ 4ē ® Cl 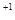 4 3 восстановление
4 3 восстановление
Общее количество электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Общее наименьшее кратное для отданных и принятых электронов равно 12. Разделив это число на 6 (число отданных электронов), получаем коэффициент 2 для восстановителя. При делении общего наименьшего кратного на 4 (число принятых электронов), получаем коэффициент 3 для окислителя. Для продукта окисления 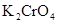 проставляем коэффициент 4, так как в состав этой молекулы входит только один атом хрома. Для продукта восстановления
проставляем коэффициент 4, так как в состав этой молекулы входит только один атом хрома. Для продукта восстановления 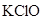 ставим коэффициент 3. Остальные коэффициенты уравнения находим подсчетом баланса элементов в последовательности: калий, водород.
ставим коэффициент 3. Остальные коэффициенты уравнения находим подсчетом баланса элементов в последовательности: калий, водород.
Правильность уравнивания подтверждается подсчетом атомов кислорода. Окончательное уравнение реакции:
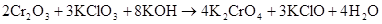
восста- окислитель продукт продукт
новитель окисления восстановления
в) 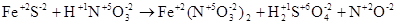
В данной реакции меняют степень окисления атомы серы и азота, реакция относится к окислительно-восстановительным. Степень окисления серы повышается от -2 до +6, азота понижается от +5 до +2, следовательно 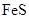 - восстановитель,
- восстановитель, 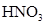 - окислитель.
- окислитель.


 Электронные уравнения имеют следующий вид:
Электронные уравнения имеют следующий вид:
S-2 – 8ē ® S+6 8 3 окисление
24
N+5 + 3ē ® N+2 3 8 восстановление
Общее наименьшее кратное для отданных и принятых электронов равно 24. Разделив это число на 8, получаем коэффициент 3 для восстановителя (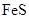 ) и продукта его окисления (
) и продукта его окисления ( ), а при делении 24 на 3 получаем коэффициент 8 для окислителя (HNO3) и продукта его восстановления (
), а при делении 24 на 3 получаем коэффициент 8 для окислителя (HNO3) и продукта его восстановления (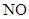 ). Коэффициенты перед веществами, атомы которых не меняют степень окисления, находим подбором. Для уравнивания атомов железа в правую часть к
). Коэффициенты перед веществами, атомы которых не меняют степень окисления, находим подбором. Для уравнивания атомов железа в правую часть к 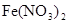 проставляем коэффициент 3. Азотная кислота
проставляем коэффициент 3. Азотная кислота 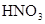 в данной реакции выполняет две функции – является окислителем и связывая 3 иона
в данной реакции выполняет две функции – является окислителем и связывая 3 иона 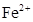 в 3 молекулы соли
в 3 молекулы соли 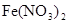 дополнительно расходуется на солеобразование в количестве 6 молекул. Поэтому перед окислителем в уравнении реакции проставляем коэффициент 14. В ходе реакции образуется 4 молекулы воды.
дополнительно расходуется на солеобразование в количестве 6 молекул. Поэтому перед окислителем в уравнении реакции проставляем коэффициент 14. В ходе реакции образуется 4 молекулы воды.
Окончательное уравнение реакции:
|
|
|
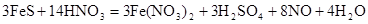
восста- окислитель продукт продукт
новитель окисления восстановления
ЗАДАНИЯ
221-240.
 2015-01-30
2015-01-30 929
929








