Повышенное содержание ионов Ca2+ и Mg2+ обусловливает жесткость природной воды. Известно, что использование такой воды приводит к отложению солей в теплосиловых установках, системах охлаждения дизелей, локомотивов и т.п. В частности, слой накипи толщиной в 1 мм на поверхности теплообменных аппаратов вызывает перерасход топлива на 1,5-2,5%.
Жесткость воды Ж характеризуется числом миллимоль-эквивалентов солей жесткости (Ca2+ и Mg2+), содержащихся в 1 л воды. Поэтому размерность жесткости Ж = [моль-экв/л или сокращенно Ж = [ммоль/л]. В технических расчетах размерность жёсткости воды несколько отличается Ж = [ммоль/кг]. Жесткость воды, рассчитанная по химической и технической шкале, практически совпадает, поскольку плотность воды близка к единице.
Если в воде имеется несколько видов ионов, обусловливающих жесткость, то общая жесткость воды складывается из суммы жесткостей Ж1 и Ж2 отдельных компонентов.
Пример 1. В 2 л воды, содержащей 48 мг ионов Mg2+, растворили 0,408 г сульфата кальция. Какова общая жесткость полученного раствора?
|
|
|
Решение. Прежде всего определим эквиваленты обоих веществ в растворе. Мольная масса магния М (Mg2+) = 24 г/моль. Мольная масса эквивалента магния (в расчете на 1 связь) МЭ (Mg2+) = 1/2 М (Mg+2) = 12 г/моль = 12 мг/ммоль.
Аналогично мольная масса МCaSO4 = 136 г/моль, а мольная масса эквивалента МЭ (CaSO4) = 1/2 М CaSO4 = 68 мг/ммоль.
Зная массы обоих веществ, находящихся в растворе, вычислим количество миллиэквивалентов обеих солей в растворе.
nЭ(Mg2+)= 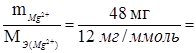 4 ммоль;
4 ммоль;
nЭ(CaSO4) = 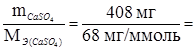 6 ммоль.
6 ммоль.
Жесткость воды, обусловленная каждой солью, рассчитывается на 1 л воды:
Ж1 = 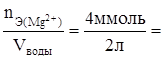 2 ммоль /л;
2 ммоль /л;
Ж2 = 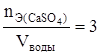 ммоль /л.
ммоль /л.
Общая жесткость полученного раствора:
Ж = Ж1 + Ж2 = 2 + 3 = 5 ммоль /л.
В зависимости от вида анионов различают карбонатную жесткость, обусловленную присутствием гидрокарбонатов Mg(HCO3)2 и Ca(HCO3)2, и некарбонатную, обусловленную присутствием солей других кислот (MgSO4, CaCl2 и др.). Такое подразделение связано с тем, что гидрокарбонаты при кипячении могут быть удалены из воды:
Ca(HCO3)2 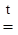 CaCO3↓ + H2O + CO2↑
CaCO3↓ + H2O + CO2↑
Общая жесткость складывается из карбонатной Жк и некарбонатной Жн: Жобщ= Жк + Жн. Если принять в примере 1, что в исходном растворе находилась соль Mg(HCO3)2, то Жк = 2 ммоль/л, Жн = 3 ммоль/л и Жобщ = 5 ммоль/л.
Принятая система оценки жесткости в миллиэквивалентах очень удобна при расчетах, т.к. позволяет использовать закон эквивалентов. Согласно этому закону, вещества реагируют в эквивалентных количествах. Число эквивалентов, находящихся в растворе, может быть вычислено:
n = C N· V, (45)
где C N - нормальная (эквивалентная) концентрация;
V - объем раствора.
Закон эквивалентов для двух реагирующих веществ записывается так:
|
|
|
n 1 = n 2 (46)
Если известны нормальные концентрации C N и объемы реагирующих растворов V, то на основании (45) и (46) справедливо следующее соотношение:
C N1· V 1 = C N2· V 2. (47)
Эта формула широко используется при объемном анализе растворов с целью установления неизвестной концентрации по объему раствора с известной концентрацией, необходимому для проведения реакции. Этот метод называют титрованием.
Пример 2. Для полной нейтрализации соли CaSO4, находящейся в 200 мл воды, при титровании добавили 20 мл 0,05 Н раствора HCl. Какова жесткость воды? Сколько граммов соды необходимо добавить к 1 м3 этой воды для ее полного умягчения?
Решение. Найдем концентрацию солей жесткости в воде, используя соотношение (47):
С ж = 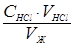 ,
,
где С ж – концентрация солей жесткости, моль/л;
V ж – объем исследуемой воды.
С ж = 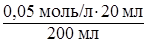 = 0,005 моль/л.
= 0,005 моль/л.
Это соответствует жесткости:
Ж = С ж × 1000= 5 ммоль/л.
Теперь найдем количество моль-эквивалентов соли CaSO4 в 1 м3 (1000 л) по формуле (45):
n ж = Ж× V = 5 ммоль/л × 1000 л = 5000 ммоль = 5 моль-экв. = 5 моль.
По закону эквивалентов (46) такое же количество эквивалентов солей жесткости необходимо для полного умягчения воды:
n Na2CO3 = n ж = 5 моль-экв.
Вычислим мольную массу эквивалента соды:
М Э(Na2CO3) = 1/2 М (Na2CO3) = 106/2 = 53 г/моль.
Тогда масса добавляемой соды
m Na2CO3 = n Na2CO3 × М Э(Na2CO3) = 265 г.
Заметим, что при использовании закона эквивалентов и нормальных концентраций отпадает необходимость в записи уравнений реакций для проведения расчетов.
В приведенном примере 2 дан расчет количества реагента, необходимого для устранения жесткости воды. С этой целью используются как простые неорганические, так и полимерные реагенты – иониты.
Для уменьшения карбонатной жесткости применяют метод известкования (реагент Ca(OH)2):
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O.
При этом соли жесткости выпадают в осадок. Этим методом невозможно устранить некарбонатную жесткость. В последнем случае в качестве реагента используется сода:
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4.
В промышленности для умягчения воды широко используются природные и синтетические иониты. В них полимерные ионы образуют основу (матрицу), а ионы противоположного знака подвижны и легко вступают в ионный обмен с солями жесткости. При этом различают катиониты:
2RNa + Ca2+ = CaR2 +2Na+
и аниониты:
2ROH + SO42- = R2SO4 + 2OH -
Часто для обессоливания воды последовательно используются катиониты и аниониты.
Основной характеристикой ионита является обменная емкость. Она показывает максимальное количество ионов (в ммоль/г), поглощаемое 1 г ионита при реакции обмена.
Ее рассчитывают следующим образом:
e = 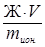 , (48)
, (48)
где Ж - жесткость обрабатываемой воды, ммоль/г;
V - ее объем, л;
m ион - масса ионита, г.
Пример 3. Обменная емкость пермутита (Na2O × Al2O3 × nH2O) составляет
e = 6 ммоль/г. При пропускании 50 л воды через колонку, содержащую 200 г катионита, произошло полное обессоливание воды. Какова жесткость воды?
Решение. В соответствии с формулой (48) жесткость воды может быть найдена:
Ж = 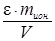 ; Ж=
; Ж= 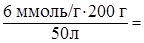 24 ммоль/л.
24 ммоль/л.
ЗАДАЧИ
221. Анализом установлено, что в 5 л воды содержится 0,4 г ионов Ca2+ и 0,12 г ионов Mg2+. Какова жесткость этой воды?
Ответ: Ж = 6 ммоль/л.
222. Чему равна жесткость воды, в 20 л которой содержится 8,1 г гидрокарбоната кальция Ca(HCO3)2?
Ответ: Ж = 5 ммоль/л.
223. Анализом установлено, что в 20 л воды содержится 7,3 г Mg(HCO3)2 и 0,95 г MgCl2. Вычислите карбонатную, некарбонатную и общую жесткость воды.
Ответ: Ж к = 5; Жн = 1; Жо = 6 ммоль/л.
224. В 5 л воды содержится 0,61 г ионов HCO3- и 0,24 г ионов SO42-. Вычислите карбонатную, некарбонатную и общую жесткость воды.
Ответ: Жк = 2; Жн = 1; Жо = 3 ммоль/л.
225. Общая жесткость воды, содержащей СаCl2 и Mg(HCO3)2, составляет 7 ммоль/л. Какова некарбонатная жесткость, если в 1 л воды содержится 0,146 г Mg(HCO3)2?
Ответ: Жн = 5 ммоль/л.
226. Общая жесткость воды, содержащей MgCl2 и Mg(HCO3)2, составляет 5 ммоль/л. Какова карбонатная и некарбонатная жесткость, если на титрование 200 мл воды израсходовано 40 мл 0,015 н раствора HCl?
|
|
|
Ответ: Жк = 3; Жн = 2 ммоль/л.
227. На титрование 100 мл воды израсходовано 15 мл 0,05 н раствора комплексона (общая жесткость) и 25 мл 0,01 н раствора HCl на то же количество воды. Вычислите общую, карбонатную и некарбонатную жесткость воды.
Ответ: Жк = 2,5; Жн = 5; Жо = 7,5 ммоль/л.
228. В природной воде с жесткостью 5 ммоль/л находится только гидрокарбонат магния. Сколько граммов Mg(HCO3)2 находится в 1 м3 этой воды?
Ответ: 365 г.
229-234. Сколько граммов реагента А необходимо добавить к V литров воды с жесткостью Ж для того, чтобы полностью удалить соли жесткости. Какой вид жесткости устраняется данным реагентом?
| № задачи | А | V, л | Ж | Ответы |
| Ca(OH)2 | 25,9 | |||
| Na2CO3 | 26,5 | |||
| Na3PO4 | 273,5 | |||
| Ca(OH)2 | 14,8 | |||
| Na2CO3 | ||||
| Na3PO4 | 10,93 |
235-240. Обменная емкость ионита равна e. При пропускании V литров воды через колонку, содержащую m граммов ионита, произошло полное обессоливание воды. Какова жесткость воды?
| № задачи | Ионит | e | V, л | m, г | Ответы |
| Сульфоуголь | |||||
| Пермутит | |||||
| Каолиновая глина | |||||
| КУ-2 | 12,5 | ||||
| Пермутит | |||||
| Каолиновая глина | 7,2 |
 2015-01-30
2015-01-30 2591
2591
