В основе определения общей жесткости (ЖОБЩ) воды лежит трилонометрический метод. Рабочим раствором является трилон Б – двунатриевая соль этилендиаминтетрауксусной кислоты (Na2H2R) – ЭДТА.
Определение суммарного содержания ионов кальция и магния основано на способности трилона Б образовывать с этими ионами прочные комплексные соединения в щелочной среде.
Са 2+ + Na2H2R → Na2CaR + 2Н+
где R – радикал этилендиаминтетрауксусной кислоты.
В качестве индикатора используется хромоген черный, который в присутствии ионов Mg2+ и Са2+ окрашивается в сиреневато-розовый цвет, при исчезновении этих ионов приобретает голубую окраску. Реакция идет при рН = 10, что достигается добавлением в пробу аммиачного буферного раствора (NH4OH + NH4Cl).
Выполнение опыта
Первоначально приготовьте раствор для титрования: в бюретку налейте раствор ЭДТА с эквивалентной концентрацией 0,02 ммоль-экв/дм3 и установите уровень этого реактива на нулевом делении.
С помощью мензурки отмерьте 50 см3исследуемой воды и перенесите ее в коническую колбу для титрования. В эту колбу добавьте 50 см3 дистиллированной воды (используйте также мензурку), тем самым общий объем воды будет доведен до 100 см3. Далее, в эту колбу прилейте 5 см3 буферного раствора (смесь NH4OH и NH4Cl), что необходимо для поддержания величины рН в интервале 9-10. После этого добавьте 2-3 капли индикатора хромогена черного (обратите внимание на окраску индикатора в растворе). Раствор хорошо перемешайте и сразу же начинайте титрование. При этом раствор ЭДТА приливайте осторожно, по каплям, при постоянном перемешивании. Наблюдайте за изменением окраски раствора от сиреневого до голубого цвета. После этого титрование прекратите и определите объем ЭДТА, израсходованного на титрование раствора. Аналогично проведите титрование еще в двух параллелях (каждый раз колбу после титрования тщательно ополаскивайте дистиллированной водой).
Запись результатов опыта
Экспериментальные данные представьте в виде таблицы:
| № опыта | Объем воды, (VH2O , см3) | Объем раствора ЭДТА, (VЭДТА , см3) | Средний объем ЭДТА
(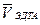 , см3) , см3)
| Эквивалентная концентрация раствора ЭДТА (Сэкв) |
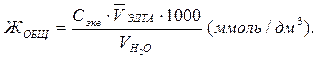 |
Общую жесткость воды рассчитайте по формуле:
Вычислите постоянную жесткость воды, принимая во внимание, что:
ЖПОСТ = ЖОБЩ - ЖВР
В выводе ответьте на вопрос, к какому типу жесткости относится исследованная вода и какой жесткостью – Жвр или Жпост в большей степени обусловлена Жобщ.
Вопросы для самоконтроля знаний
1. Наличием каких ионов обусловлена общая жесткость воды, и в каких единицах она выражается?
2. Дайте понятие общей, временной и постоянной жесткости воды.
3. Какая жесткость допустима для питьевой воды?
4. Как влияет жесткая вода на здоровье человека и его жизнедеятельность?
5. Как можно устранить временную и постоянную жесткость воды?
6. Какими путями происходит загрязнение питьевой воды солями магния и кальция?
7. Как определяют временную жесткость воды?
8. Как определяют общую жесткость воды?
9. Определите карбонатную жесткость, если на титрование 200 см3 H2O израсходовано 8 см3 раствора HCl концентрацией 0,05моль-экв/дм3.
 2015-02-27
2015-02-27 1367
1367








