Исследование равновесия химических реакций проводится различными статическими и динамическими методами. Однако часто такие опредения сопряжены с большими трудностями вследствие высоких температур и давлений, возможности нарушения равновесия и других причин, тому первостепенное значение имеют расчетные методы определения констант равновесия с использованием термодинамических параметров (∆G0, ∆H0, S и др.).
В основе расчета констант равновесия реакций при любых температурах лежит уравнение для стандартной энергии Гиббса ΔG0Т:
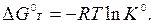
Энергия Гиббса при данной температуре Т связана с тепловым эффектом химической реакции ΔH0Т и изменением энтропии уравнением ΔS0Т:
ΔG0Т = ΔH0Т – T ΔS0Т
Тепловой эффект реакции при заданной температуре находят по уравнению Кирхгофа:
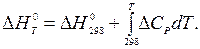
Изменение энтропии реакции при заданной температуре находят по аналогичному уравнению:
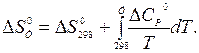
Откуда
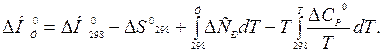
Подставим в формулу температурную зависимость теплоёмкости, выражаемую степенным рядом
ΔСр = Δа + ΔbT + ΔcT2 + ΔdT3 + Δc′ 1/T2….
Проинтегрировав получим:
ΔG0Т = ΔH0298 – T ΔS0298 – T(Δa M0 + Δb M1 + ΔcM2 + Δc´M-2)
Темкин и Щварцман составили таблицы для расчета коэффициентов M0, M1, M2, M-2 в уравнении, поэтому определение констант равновесия с помощью этих значений называют методом Темкина-Щварцмана.
 2014-05-17
2014-05-17 10971
10971
