- Изменение температуры, встряхивание или перемешивание, облучение – любое энергетическое воздействие на систему приведет к ускорению движения частиц и большей вероятности их столкновений.
- При добавлении электролитов происходит уменьшение диффузного слоя, уменьшение дзета-потенциала частицы. Если заряд на частицах становиться равен нулю (изоэлектрическое состояние) частицы могут слипаться.
2. Правила коагуляции электролитами:
1). Коагуляцию лиофобных золей могут вызвать любые электролиты. Но коагулирующим действием обладают ионы противоположные по знаку грануле.
2). Каждый электролит характеризуется пороговой концентрацией (порогом коагуляции) – количество ммоль электролита, которое надо добавить к 1 л коллоидного раствора, чтобы вызвать его коагуляцию. Величина обратная порогу коагуляции называется коагулирующей способностью.
3 ). Коагулирующая способность ионов увеличивается с увеличением их заряда (правило Шульце- Гарди: порог коагуляции обратно пропорционален заряду иона в 6 степени) и уменьшается с увеличением радиуса гидратированного иона.
|
|
|
Al3+> Ca2+>K+
PO43-> SO42-> Cl-
K+ > Na+> Li+
CNS->I-> Br-> Cl-
4). Коагулирующая способность многих органических веществ (алкалоиды, красители) больше чем у электролитов. Высокой коагулирующей способностью обладает ионы Н+ и ОН -.
5). Коагуляция многих лиофобных золей наступает раньше, чем достигается их изоэлектрическое состояние.
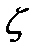 -потенциал при котором начинается явная коагуляция называется критическим потенциалом
-потенциал при котором начинается явная коагуляция называется критическим потенциалом 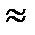 30 мВ)
30 мВ)
Коагуляция в биосистемах. Процесс свертывания крови – сложный ферментативный процесс. Коагуляционным этапом процесса свертывания крови является 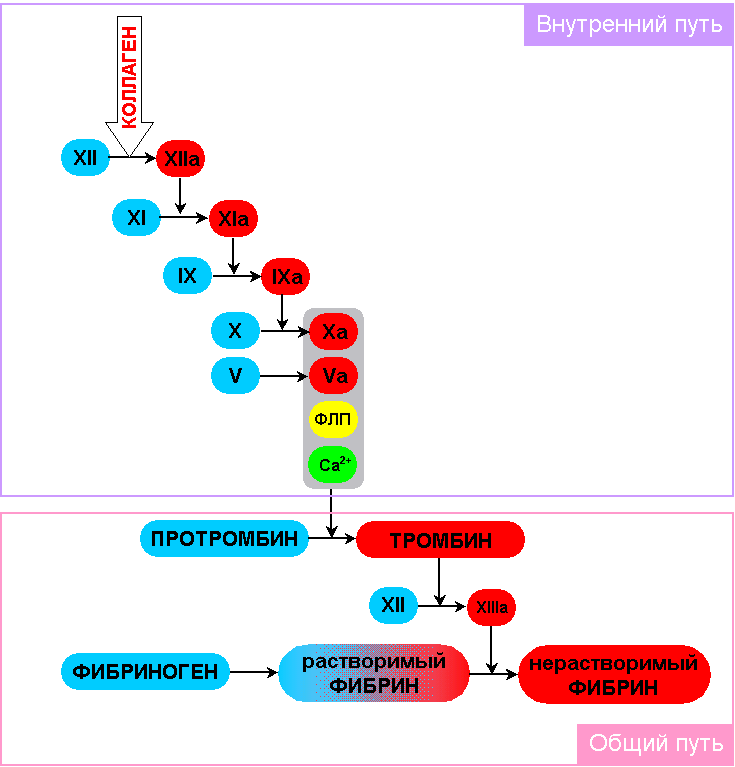 образование тромбина, который, действуя на фибриноген, вызывает образование нитей нерастворимого фибрина и образование сгустков. В крови действует не только система свертывания, но и система антисвертывающая, основой которой является гепарин. Часто при сильных кровотечениях или образовании тромбов проводят коагулограмму - совокупность анализов на содержание протромбина, фибриногена, толерантность к гепарину, время рекальцификации и т.д.
образование тромбина, который, действуя на фибриноген, вызывает образование нитей нерастворимого фибрина и образование сгустков. В крови действует не только система свертывания, но и система антисвертывающая, основой которой является гепарин. Часто при сильных кровотечениях или образовании тромбов проводят коагулограмму - совокупность анализов на содержание протромбина, фибриногена, толерантность к гепарину, время рекальцификации и т.д.
 При консервировании крови, при обработке посуды предназначенной для анализов, при создании современных материалов для протезирования надо учитывать процессы коагуляции. Например, добавка цитрата натрия переводит кальций в осадок, и кровь, обработанная таким образом может храниться до 30 суток (на холоду). Посуду, предназначенную для анализа крови, обрабатывают специальными составами, чтобы их поверхность приобрела водоотталкивающие свойства. При контакте с такой поверхностью тромбоциты не активируются, и свертывания крови не происходит. Такими же свойствами должны обладать материалы, используемые для протезирования сосудов.
При консервировании крови, при обработке посуды предназначенной для анализов, при создании современных материалов для протезирования надо учитывать процессы коагуляции. Например, добавка цитрата натрия переводит кальций в осадок, и кровь, обработанная таким образом может храниться до 30 суток (на холоду). Посуду, предназначенную для анализа крови, обрабатывают специальными составами, чтобы их поверхность приобрела водоотталкивающие свойства. При контакте с такой поверхностью тромбоциты не активируются, и свертывания крови не происходит. Такими же свойствами должны обладать материалы, используемые для протезирования сосудов.
|
|
|
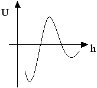 Существует теория ДЛФО (Дерягина – Ландау – Фервея – Овербека), сущность которой состоит в учете молекулярных сил притяжения и электростатических отталкивания при сближении двух одинаково заряженных частиц. Согласно этой теории силы притяжения начинают действовать только на расстояниях, сравнимых с радиусом частиц. Электростатическое отталкивание возникает при перекрывании их диффузионных слоев. Небольшой минимум энергии при больших расстояниях между частицами соответствует явлению тиксотропии (гель
Существует теория ДЛФО (Дерягина – Ландау – Фервея – Овербека), сущность которой состоит в учете молекулярных сил притяжения и электростатических отталкивания при сближении двух одинаково заряженных частиц. Согласно этой теории силы притяжения начинают действовать только на расстояниях, сравнимых с радиусом частиц. Электростатическое отталкивание возникает при перекрывании их диффузионных слоев. Небольшой минимум энергии при больших расстояниях между частицами соответствует явлению тиксотропии (гель  золь), объясняет способность некоторых простейших образовывать цепочки, не соприкасаясь между собой. Максимум (энергетический барьер) – характеризует область устойчивости КС. Если кинетической энергии частиц хватит, чтобы его преодолеть, значит, частицы объединятся. Если нет – частицы не смогут образовать агрегаты. Глубокая потенциальная яма – соответствует прочной связи частиц в агрегатах при малых расстояниях между ними. Теория ДЛФО позволила объяснить многие процессы в КС.
золь), объясняет способность некоторых простейших образовывать цепочки, не соприкасаясь между собой. Максимум (энергетический барьер) – характеризует область устойчивости КС. Если кинетической энергии частиц хватит, чтобы его преодолеть, значит, частицы объединятся. Если нет – частицы не смогут образовать агрегаты. Глубокая потенциальная яма – соответствует прочной связи частиц в агрегатах при малых расстояниях между ними. Теория ДЛФО позволила объяснить многие процессы в КС.
Коллоидная защита. Мы уже говорили, что растворы ВМС являются лиофильными, устойчивыми. Большую устойчивость растворов ВМС используют для стабилизации лиофобных золей. Стабилизация золей по отношению к электролитам путем добавления незначительного количества ВМС получила название коллоидной защиты. Такое действие ВМС обусловлено способностью молекул полимера адсорбироваться на поверхности коллоидных частиц и предохранять их от непосредственного соприкосновения между собой, а значит и от агрегации. Кроме того, защищенный золь приобретает свойства адсорбированного полимера, у частицы уменьшается поверхностное натяжение, система становится лиофильной, устойчивой.
Защитное действие ВМС весьма специфично. Оно зависит и от природы защищаемого коллоидного раствора, и от природы ВМС, от степени дисперсности коллоида и рН среды. Если для одних золей полисахариды являются стабилизаторами, то для других они не проявляют защитного действия. Аналогично – растворы белков. В общем случае защитное действие того или другого вещества определяется конкретно по отношению к изучаемой КС, и характеризуется его защитным числом. Защитное число – это количество мг сухого ВМС, которое надо добавить к 10 мл исследуемого золя, чтобы защитить его от коагуляции.
 Большое значение имеет коллоидная защита для живых организмов. Защитным действием обладают различные белки, полисахариды, пектины. Они адсорбируются на коллоидных частицах карбонатов, фосфатов, липидов и т.д. переводя их в устойчивое состояние. Примером таких защищенных систем являются кровь, моча, молоко. Если выпарить 1 л мочи, собрать получившийся осадок и попытаться его растворить, то понадобиться 7-14 л воды. С возрастом или при патологии коллоидная защита нарушается, и образуются осадки малорастворимых веществ в почках, протоках печени и т.д. К заболеваниям такого типа относится и одну из стадий атеросклероза – атерокальциноз сосудов, отложение холестерина в желчных протоках, мочекаменная болезнь и т.д.
Большое значение имеет коллоидная защита для живых организмов. Защитным действием обладают различные белки, полисахариды, пектины. Они адсорбируются на коллоидных частицах карбонатов, фосфатов, липидов и т.д. переводя их в устойчивое состояние. Примером таких защищенных систем являются кровь, моча, молоко. Если выпарить 1 л мочи, собрать получившийся осадок и попытаться его растворить, то понадобиться 7-14 л воды. С возрастом или при патологии коллоидная защита нарушается, и образуются осадки малорастворимых веществ в почках, протоках печени и т.д. К заболеваниям такого типа относится и одну из стадий атеросклероза – атерокальциноз сосудов, отложение холестерина в желчных протоках, мочекаменная болезнь и т.д.
Явления коллоидной защиты используют при изготовлении лекарств: колларгол, протаргол, лизоргинон (золи серебра, серы, ртути).
В некоторых случаях добавление малого количества ВМС может привести к осаждению коллоидных частиц (если молекула ВМС адсорбируется своими концами на разных коллоидных частицах и общая масса частицы существенно увеличивается). Явление осаждения коллоидных частиц под действием неэлектролитов называется флокуляцией. Она используется для очистки коллоидных растворов.
|
|
|
Процесс перехода осадка во взвешенное состояние под действием внешних факторов, называется пептизацией. Вещества, способствующие пептизации – пептизаторы (часто их называют просто стабилизаторами). Такими пептизаторами могут быть белки, полисахариды и даже мыла. Этот процесс обусловлен адсорбционными явлениями, в результате которых изменяется значение 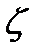 - потенциала. На основе явления пептизации основано действие моющих средств.
- потенциала. На основе явления пептизации основано действие моющих средств.
Эмульсии – КС, в которых одна жидкость диспергирована в другой. Размеры частиц обычно достаточно большие – 10-6-10-7. Конечно, жидкости д.б. нерастворимы или слабо растворимы друг в друге. Если одна из них вода (полярная жидкость), то другую обычно называют «масло» (неполярная), даже если это вовсе не масло. Эмульсии масла в воде называют прямыми, а эмульсии воды в масле – обратными. Эти эмульсии сильно отличаются по электропроводности, природе растворяемых веществ и т.д. Классический пример: фенол- вода. При критической температуре 65,9о жидкости смешиваются неограниченно, поверхностное натяжение равно 0. При температуре немного ниже критической самопроизвольно образуется эмульсия, слабое стремление к слиянию частиц уравновешивается энтропийным фактором (стремлением к увеличению беспорядка). При понижении температуры начинает преобладать стремление понизить энергию системы за счет уменьшения площади поверхности раздела. При этом может образоваться две жидких фазы: фенол и вода. Существенное понижение поверхностного натяжения и самопроизвольное образование эмульсии можно добиться и путем добавления к коллоидным системам ПАВов. Этот процесс может происходить и в организме. Система таурохолат (желчная соль) – моноглицерид олеиновой кислоты при рН 6.0-8.5 обладает очень низким поверхностным натяжением. И эмульсия в кишечнике образуется практически самопроизвольно. Но чаще всего такого понижения  не происходит, и система подчиняется коллоидным механизмам устойчивости. Т.е. для образования коллоидной системы необходимо перемешивание, вибрация, ультразвук и т.д. Хорошими стабилизаторами (ПАВами) являются лауриновая и миристиновая кислоты, мыла и другие вещества. После гомогенизации эмульсии (так называют этот процесс), размер частиц уменьшается до 0,2 мкм, и она становится устойчивой длительное время. Причем свойства эмульсий и даже ее тип может зависеть от типа эмульгатора. Например: белки, камеди, декстрины, мыла щелочных металлов дают прямые эмульсии, а стеарины, мыла многовалентных металлов – обратные эмульсии. Могут применяться также твердые эмульгаторы: гипс, графит и т.д. способные скапливаться на границе раздела фаз, благодаря избирательной смачиваемости. Для эмульсионных мазей, применяемых в фармации, обычно в роли эмульгаторов применяют мыла кальция, магния, цинка, алюминия или соответствующие соли смоляных кислот. В организме жиры и липиды переносятся кровью в виде хиломикронных эмульсий, обеспечивая жировое питание. В фармацевтической промышленности многие лекарства применяются в виде эмульсий, причем прямые эмульсии обычно используются во внутренних лекарствах, а обратные – в наружных средствах. В ряде случаев эмульгированием удается ослабить неприятный запах или вкус. Чаще всего для лекарственных препаратов в качестве эмульгаторов используют крахмал, яичный желток, камедь, декстрин, желатину, казеинат натрия (внутрь). Эмульсии акрифлавина, этиламинбензоата используют для местной анестезии, бактерицидные эмульсии (до 97% масла) – для лечения ожогов и т.д.
не происходит, и система подчиняется коллоидным механизмам устойчивости. Т.е. для образования коллоидной системы необходимо перемешивание, вибрация, ультразвук и т.д. Хорошими стабилизаторами (ПАВами) являются лауриновая и миристиновая кислоты, мыла и другие вещества. После гомогенизации эмульсии (так называют этот процесс), размер частиц уменьшается до 0,2 мкм, и она становится устойчивой длительное время. Причем свойства эмульсий и даже ее тип может зависеть от типа эмульгатора. Например: белки, камеди, декстрины, мыла щелочных металлов дают прямые эмульсии, а стеарины, мыла многовалентных металлов – обратные эмульсии. Могут применяться также твердые эмульгаторы: гипс, графит и т.д. способные скапливаться на границе раздела фаз, благодаря избирательной смачиваемости. Для эмульсионных мазей, применяемых в фармации, обычно в роли эмульгаторов применяют мыла кальция, магния, цинка, алюминия или соответствующие соли смоляных кислот. В организме жиры и липиды переносятся кровью в виде хиломикронных эмульсий, обеспечивая жировое питание. В фармацевтической промышленности многие лекарства применяются в виде эмульсий, причем прямые эмульсии обычно используются во внутренних лекарствах, а обратные – в наружных средствах. В ряде случаев эмульгированием удается ослабить неприятный запах или вкус. Чаще всего для лекарственных препаратов в качестве эмульгаторов используют крахмал, яичный желток, камедь, декстрин, желатину, казеинат натрия (внутрь). Эмульсии акрифлавина, этиламинбензоата используют для местной анестезии, бактерицидные эмульсии (до 97% масла) – для лечения ожогов и т.д.
|
|
|
Пены по природе близки к концентрированным эмульсиям, но дисперсной фазой является газ. Устойчивость пен зависит от устойчивости пленочного каркаса жидкости. Если пленка образована чистой низкомолекулярной жидкостью, то прочность ее не велика. Хорошими стабилизаторами пен являются все те же ПАВы.
Аэрозоли – золи у которых дисперсная среда– газ, дисперсная фаза может быть жидкостью (туман) или твердым веществом (дым). Особенностью аэрозолей является наличие у них только кинетической устойчивости. Они лишены агрегативной устойчивости, и каждое соприкосновение их частиц приводит к слипанию. Поэтому нельзя получить аэрозоли высокой концентрации. Для здравоохранения актуальное значение имеют различные патогенные аэрозоли, потому что именно так передаются многие инфекции или возникают профзаболевания. Для осаждения «грубых» аэрозолей применяют циклотроны, тканевые и волокнистые фильтры, электрофильтры. В медицине часто применяют аэрозоли для введения в организм лекарственных и антибиотических веществ в виде ингаляций.
Особое положение среди коллоидных систем занимают растворы ВМС. Поскольку они имеют важное значение для организма человека, нам необходимо рассмотреть особенности свойств таких лиофильных коллоидных систем.
ВМС ( высокомолекулярными соединениями) или полимерами называют соединения с молекулярной массой 10 000 – 1 000 000. Макромолекулы ВМС построены из большого числа повторяющихся групп атомов, которые называются структурными звеньями. Число таких звеньев в молекуле называется степенью полимеризации, а сама макромолекула – молекулой полимера. Свойства полимеров зависят не только от состава, но и от пространственного строения макромолекулы. По этому признаку различают линейные, разветвленные и сшитые полимеры… По происхождению ВМС делят на природные и синтетические. Природные ВМС составляют основу живых организмов. К ним относятся полисахариды, белки и нуклеиновые кислоты. Полисахариды являются полимерами глюкозы или других моносахаридов. Они входят в состав клеточных мембран, являются запасной формой питательных веществ (крахмал, гликоген, целлюлоза, гликопротеиды). Нуклеиновые кислоты (РНК и ДНК) обладают очень высокой молекулярной массой, состоят из сотен тысяч нуклеотидов. Белки образуются остатками 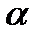 -аминокислот. Таких остатков в полипептидной цепи может быть и несколько десятков и несколько сот тысяч. В организме человека содержится до 5 млн. различных белков. В отличии от низкомолекулярных веществ ВМС не имеют определенной молекулярной массы и характеризуются ее средним значением. Поэтому ВМС, в отличии от низкомолекулярных соединений, не имеют определенной плотности и температуры плавления. Все физические и химические процессы с их участием протекают очень медленно. Если в низкомолекулярных растворах равновесие достигается в течении нескольких минут или часов, то в растворах полимеров для этого требуются недели или даже месяцы. Это связано с очень маленькой скоростью диффузии макромолекул. Медленное протекание процессов в растворах ВМС должно всегда учитываться во избежание ошибок при толковании экспериментальных результатов.
-аминокислот. Таких остатков в полипептидной цепи может быть и несколько десятков и несколько сот тысяч. В организме человека содержится до 5 млн. различных белков. В отличии от низкомолекулярных веществ ВМС не имеют определенной молекулярной массы и характеризуются ее средним значением. Поэтому ВМС, в отличии от низкомолекулярных соединений, не имеют определенной плотности и температуры плавления. Все физические и химические процессы с их участием протекают очень медленно. Если в низкомолекулярных растворах равновесие достигается в течении нескольких минут или часов, то в растворах полимеров для этого требуются недели или даже месяцы. Это связано с очень маленькой скоростью диффузии макромолекул. Медленное протекание процессов в растворах ВМС должно всегда учитываться во избежание ошибок при толковании экспериментальных результатов.
Рассмотрим процесс растворения ВМС. Растворимость ВМС, как и других соединений, определяется в первую очередь природой вешества и растворителя (подобное в подобном). Но не последнюю роль играет здесь и пространственное строение полимера. Процесс растворения для ВМС является самопроизвольным, но проходит через стадию набухания. Прежде чем перейти в раствор, полимер, поглощая значительное количество низкомолекулярной жидкости – растворителя, увеличивается в объёме и массе, это явление и называют набуханием.Твердые по агрегатному состоянию полимеры не имеют правильного кристаллического строения. Небольшие молекулы растворителя заполняют пространство между макромолекулами, раздвигают звенья цепей и ослабляют межмолекулярные связи в полимере. Образующиеся щели заполняются новыми молекулами растворителя. Расстояние между макромолекулами увеличивается, поэтому при набухании полимер увеличивается в массе и в объёме. Таким образом, набухание – это проникновение низкомолекулярной жидкости в среду молекул высокомолекулярного соединения и связанное с этим раздвигание звеньев, а затем и цепей макромолекул.
В общем случае процесс набухания происходит в две стадии. На первой стадии поглощается небольшое количество растворителя, которое идёт на гидратацию макромолекул. Эта стадия характеризуется выделением некоторого количества теплоты. Измерения теплоты набухания показали, что энергетически прочно с полимером связывается очень небольшое количество растворителя. Гидратный слой в растворах полимеров мономолекулярен. Эта стадия набухания характеризуется уменьшением суммарного объёма полимера и растворителя, т е. происходит объёмное сжатие. Растворитель в сольватных оболочках изменяет свои физические свойства, плотность его становится больше, диэлектрическая проницаемость и давление насыщенного пара уменьшается. Т.н. гидратная вода обладает особыми свойствами и уже не участвует в процессах растворения. На второй стадии набухания полимер поглощает много жидкости без выделения теплоты. Низкомолекулярная жидкость в результате диффузии проникает в пустоты между макромолекулами. На этой стадии наблюдается увеличение объёма системы, которое может заканчиваться процессом растворения, т. е. распределением макромолекул полимера по всему объёму растворителя.
Справедливости ради, надо сказать, что ВМС способны образовывать не только истинные растворы, но и типичные лиофобные золи, если в качестве дисперсионной среды использовать такую жидкость, по отношению к которой данное высокомолекулярное вещество является лиофобным, т.е. не способным растворяться в нем.
 В зависимости от строения полимера набухание может быть ограниченным и неограниченным, подобно ограниченной и неограниченной растворимости двух жидкостей. Неограниченное набухание – это набухание, которое заканчивается растворением. Связи между макромолекулами в результате набухания ослабляются, и молекулы полимера переходят в растворитель, образуется гомогенный раствор. Процесс этот идёт самопроизвольно. Так набухают и растворяются альбумины и желатина в теплой воде, целлюлоза в ацетоне. Ограниченное набухание – это набухание, не переходящее в растворение. Полимер поглощает растворитель, увеличивается в объеме, но молекулы ВМС в растворитель практически не переходят, как бы долго он ни находился в контакте с полимером. Набухшее тело сохраняет форму и чёткую границу раздела с жидкой средой, но становится более прозрачным и эластичным. Ограниченно набухают полимеры, которые имеют очень большую молекулярную массу или химические связи – «мостики» - между макромолекулами (сшитое строение). Такие «мостики» не дают возможности макромолекулам оторваться друг от друга и перейти в раствор. Отрезки цепей между «мостиками» могут изгибаться под действием растворителя. Поэтому полимер может набухать, но растворяться не может. Примером ограничено набухающего полимера может служить коллаген или клетчатка в воде, резина в бензоле…
В зависимости от строения полимера набухание может быть ограниченным и неограниченным, подобно ограниченной и неограниченной растворимости двух жидкостей. Неограниченное набухание – это набухание, которое заканчивается растворением. Связи между макромолекулами в результате набухания ослабляются, и молекулы полимера переходят в растворитель, образуется гомогенный раствор. Процесс этот идёт самопроизвольно. Так набухают и растворяются альбумины и желатина в теплой воде, целлюлоза в ацетоне. Ограниченное набухание – это набухание, не переходящее в растворение. Полимер поглощает растворитель, увеличивается в объеме, но молекулы ВМС в растворитель практически не переходят, как бы долго он ни находился в контакте с полимером. Набухшее тело сохраняет форму и чёткую границу раздела с жидкой средой, но становится более прозрачным и эластичным. Ограниченно набухают полимеры, которые имеют очень большую молекулярную массу или химические связи – «мостики» - между макромолекулами (сшитое строение). Такие «мостики» не дают возможности макромолекулам оторваться друг от друга и перейти в раствор. Отрезки цепей между «мостиками» могут изгибаться под действием растворителя. Поэтому полимер может набухать, но растворяться не может. Примером ограничено набухающего полимера может служить коллаген или клетчатка в воде, резина в бензоле…
Процесс набухания характеризуется степенью набухания. Если обозначить массу полимера до набухания m0, а после набухания – m, то отношение 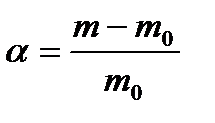 будет равно степени набухания. Т.о. степень набухания соответствует количеству граммов жидкости, поглощенной одним граммом полимера. Можно также выразить степень набухания в процентах:
будет равно степени набухания. Т.о. степень набухания соответствует количеству граммов жидкости, поглощенной одним граммом полимера. Можно также выразить степень набухания в процентах: 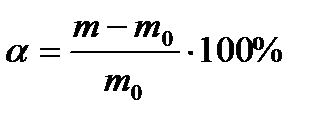
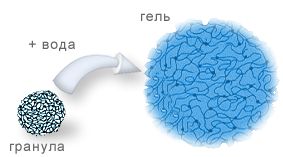 Процесс набухания в закрытых системах (т.е. при постоянном объеме) сопровождается образованием очень высоких давлений, особенно большое при поглощении первых порций воды и быстро убывающее по мере приближения к максимуму набухания (например, при набухании крахмала давление достигает в начале процесса 2.500 атм.). При набухании желатины в воде объем увеличивается в 14 раз, и если препятствовать увеличению объема, то развивается значительное давление, называемое давлением набухания.
Процесс набухания в закрытых системах (т.е. при постоянном объеме) сопровождается образованием очень высоких давлений, особенно большое при поглощении первых порций воды и быстро убывающее по мере приближения к максимуму набухания (например, при набухании крахмала давление достигает в начале процесса 2.500 атм.). При набухании желатины в воде объем увеличивается в 14 раз, и если препятствовать увеличению объема, то развивается значительное давление, называемое давлением набухания.
Влияние условий на процесс и результат набухания. Даже для одного и того же полимера характер набухания зависит от внешних условий: так, желатина и агар при повышении t° делаются неограниченно набухающими. При повышении температуры скорость набухания увеличивается, а степень набухания уменьшается. Влияние рН среды на набухание изучалось для белков и целлюлозы. Оказалось, что минимум набухания наблюдается в изоэлектрической точке (для желатины при рН=4,7). В качестве примера резкого влияния рН на процесс набухания тканей можно привести пример появления сильной отечности при укусах пчел, комаров, ожогах крапивой. При этом снижается рН и ткань мгновенно набухает за счет жидкости из соседних участков. Увеличение степени измельченности влияет на скорость набухания, так как это вызывает увеличение поверхности соприкосновения набухающего вещества с растворителем и скорости проникновения молекул растворителя в полимер. Влияет на набухание "возраст" или свежесть ВМС (особенно для белков). Чем свежее ВМС, тем больше степень и скорость набухания его. Уменьшение этих показателей связано с явлением старения ВМС, причиной которого обычно является образование связей между полипептидными цепями.
Набухание биоколлоидов играет большую роль в организме. Так, например, в начале процесса пищеварения происходит набухание пищевых веществ под влиянием механических и химических факторов организма. Наряду с осмотическими силами, набухание определяет связывание и распределение воды в тканях. Особенно большие количества воды связывает соединительная ткань. Отдельные части ее ведут себя при этом различным образом. Например, слабое подщелачивание резко усиливает набухание основного вещества, подкисление же вызывает разбухание коллагенновых волокон. Таким образом, небольшое изменение реакции вызывает перемещение и перераспределение воды между элементами ткани. Набухание соединительной ткани при различных патологиях вызывает сильные боли. Сокращение мышц, образование опухолей объясняются набуханием соответствующих тканей. При прорастании семян давление набухания разрывает прочные оболочки; эластичные стебли растений поднимаются высоко над землей, корни растений разрушают горные породы.
Давление набухания было известно и находило себе применение уже в древности: для раскалывания скал в щели вводилось сухое дерево, разрывавшее камень при размачивании. Типичным процессом набухания является приготовление пищи с применением повышенных температур и давлений. В процессе получения различных клеящих веществ важную роль играет предварительное набухание высокомолекулярных веществ в подходящих растворителях. Набухание происходит в процессе дубления кож, в производстве целлюлозы, в процессе схватывания цемента. Действие так называемых пластификаторов, повышающих эластичность и температурный интервал высокоэластичного состояния веществ, основывается на процессе набухания. Медики с давних времён использовали давление набухания смоченного гороха для расчленения черепа на составные части. Не так давно американские ученые разработали новое средство для остановки кровотечения за несколько минут в случае серьёзного ранения. Внешне новинка напоминает пакет, наполненный горохом. Его необходимо вложить в открытую рану, где гранулы полимера разбухнут и остановят ток крови. Оболочка пакета сделана из эластичного синтетического волокна, способного растягиваться под давлением образующегося геля. Порошок полимера поглощает воду и ускоряет процесс свёртывания крови (т.к. увеличивается концентрация коагулирующих веществ). Использовать новинку можно везде: она заменит собою и обычные перевязочные материалы (например, дома или в клиниках, в случае небольших ранений), и жгуты (в случае крупных потерь крови, к примеру, на поле боя). Материал поглощает большее количество жидкости, и при этом его можно оставить в ране на достаточно длительное время (несколько часов), не опасаясь за жизнь или здоровье пострадавшего.
Итак, гель (от лат. gelo- застываю) – это не текучая структурированная дисперсная система, которая образуется в результате набухания сшитых полимеров или в результате межмолекулярного взаимодействия между макромолекулами полимеров (коллоидными частицами) в концентрированных растворах полимеров.(Вспомните новогодний холодец). Такими гелями являются набухшие в водной среде ионообменные смолы; пространственно-сшитые декстраны (сефадексы) и полиакриламиды, используемые в хроматографии; набухшие в жидких углеводородах резины; гидрогели желатины, агар-агара, поливинилового спирта; органогели некоторых эфиров целюлозы и акрилонитрила.
Ячейки пространственных сеток геля заполнены растворителем. Они представляют собой твердообразные ("студенистые") тела, способные сохранять форму, обладающие упругостью (эластичностью) или пластичностью... Гели могут возникать в виде рыхлых осадков, либо образуют структурную сетку во всем объеме первоначальной жидкой системы без нарушения ее однородности. Гели с водной дисперсионной средой называют гидрогелями, с углеводородной - органогелями. Гели могут быть природного и искусственного происхождения, органические и неорганические. Естественные неорганические гели: агаты, опалы и т.д. Естественные органические (цитоплазма живых клеток, кожа, хрусталик и т.д.). Искусственные неорганические (гель кремниевой кислоты). Искусственные органические (желатина, агар-агар, каучук).
Живые организмы состоят из гелей различной степени обводненности. Тело медузы – живой гель - 98% воды, а роговая ткань (тоже гель!) содержит порядка одной десятой процента воды. Кости имеют некоторую упругость, т.к. содержат гель – оссеин. Многие продукты питания (хлеб, сыр, творог, джем), синтетические волокна и пленки тоже являются гелями.
Гелеобразование напоминает процесс коагуляции коллоидных систем. Но сходство только в однотипном влиянии факторов на оба процесса.При гелеобразовании не происходит разделения на фазы, растворитель полностью остается в системе и концентрация вещества не изменяется.
Процесс гелеобразования зависит от природы вещества: от формы молекулы (белки глобулярного типа студней не образуют, их молекулы практически не взаимодействуют между собой); от концентрации (чем больше концентрация, тем вероятнее образование геля, но желатина застывает в плотный гель уже при содержании в 2—3%, агар-агар—даже при одной десятой этой концентрации); рН раствора (лучше всего в ИЭТ); от содержания ионов (ионы, увеличивающие набухание, замедляют гелеобразование, и наоборот); температуры (с повышением температуры процесс образования гелей затрудняется).
При неограниченном набухании гель превращается в золь, т.е. в коллоидный раствор. Такое же разжижение геля и обратное его образование может происходить без поглощения им новых количеств воды. Оно происходит, например, под влиянием изменения температуры: многие гели разжижаются при нагревании, постепенно снова желатинируясь по охлаждении. Оно может быть вызвано также изменениями химического состава, в частности рН или концентрации солей. Наконец, временное, обратимое разжижение является во многих случаях результатом механического сотрясения. Это последнее явление, привлекшее к себе особенное внимание в последние годы, получило название тиксотропии; оно очень хорошо выражено в живой протоплазме. Обратимое разжижение и желатинирование протоплазмы или отдельных клеточных структур играет, повидимому, существенную роль при многих жизненных процессах. Оно имеет место при клеточном делении (кариокинетические фигуры), при амебоидном движении (уплотнение наружного слоя протоплазмы в эктоплазму и разжижение внутренней эндоплазмы), возможно, также при наркозе и т. д.
Причина образования геля - в возникновении кратковременных связей между макромолекулами. Если они существуют длительное время, гели приобретают некоторые свойства, характерные для твердых тел. При старении обратимая по отношению к механическому воздействию структура перерождается в необратимую, в системе происходят изменения, связанные с повышением твердости, потерей эластичности и т.д. Это явление называется синерезис. Гели, имеющие сперва совершенно сухую поверхность, при хранении сжимаются, выделяя на поверхности некоторое количество воды. Сам гель при этом уменьшается в объеме, становиться менее прозрачным и эластичным. Хорошо известный пример этого явления представляет сжимание кровяного сгустка, выделяющего при этом чистую сыворотку.
В гелях, как и в коллоидных растворах, может проходить диффузия. Этот процесс зависит от размера частиц (если они велики, то не пройдут через молекулярную сетку геля). На этом основано применение гелей для изготовления полупроницаемых мембран (ППМ), ионоселективных электродов, использование их для разделения молекул по размеру (гель-фильтрация).
Существует даже понятие «гелевая технология», это технология получения материалов с определенными химическими и физико-механическими свойствами. Высококонцентрированные дисперсные системы используют при производстве неорганических вяжущих веществ и различных паст. Такие системы обладают высокой пластичностью и практически неограниченной устойчивостью; структура получаемых гелей сохраняется даже при таких больших размерах частиц дисперсной фазы, как 10-4м. Это свойство используется при получении различных материалов, требующих введения в состав композиции более грубодисперсных частиц. Гели способны не только сохранять форму, но и постепенно уплотняться с повышением плотности и прочности. Этот эффект используется при формировании структуры с определенными размером пор, что очень важно при производстве сорбентов, ППМ, молекулярных сит и катализаторов. При высушивании гель превращается в твердое тонкопористое тело.
Растворы ВМС отличаются от растворов низкомолекулярных соединений повышенной вязкостью. Большая вязкость объясняется высокой гидрофильностью биополимеров. Кроме того, на величину вязкости сильно влияет форма молекулы. При течении жидкости через трубку разные ее слои, расположенные концентрическими кругами, движутся с различной скоростью. Такое равномерное движение каждого слоя называется ламинарным. Ламинарное течение характерно для чистых жидкостей, истинных растворов, некоторых коллоидов и очень разбавленных растворов ВМС. Такие жидкости называют ньютоновскими, потому что они описываются законами Ньютона и Пуазейля. В ньютоновской жидкости форма частиц сферическая, т.е. правильная. Частицы не мешают двигаться друг другу. Если частицы имеют неправильную форму, то располагаясь поперек потока жидкости, то они оказывают сопротивление течению жидкости и увеличивают ее вязкость. Тогда в растворе образуются завихрения, и такое течение называют турбулентным.
Все биологические жидкости не являются ньютоновскими, их вязкость определяется размерами, массой и формой частиц. По вязкости раствора можно определить молекулярную массу белка. Но для группы белков (*) вязкость небольшая и приблизительно одинакова, хотя молекулярная масса разная. Это говорит о глобулярной структуре белка, такая форма молекулы мало отличается от сферической частицы ньютоновского раствора.
| белок | Молекулярная масса | Характер.вязкость |
| Рибонуклеаза * | 3,3 | |
| Лизоцим* | 3,0 | |
| Миоглобин* | 3,1 | |
| Гемоглобин* | 3,5 | |
| Каталаза* | 3,9 | |
| тропомиозин | ||
| коллаген |
Определение молекулярной массы таких белков по непосредственному измерению вязкости в чистом растворителе невозможно. Поэтому добавляют денатурирующие агенты, при этом происходит разрыв дисульфидных и других мостиков, молекула приобретает вид гибкой цепи – и тогда вязкость раствора будет зависеть от молекулярной массы белка.
Вязкость или текучесть - одно из важнейших свойств крови. Вязкости крови составляет предмет биореологии. Измеряемая на капиллярных вискозиметрах (с диаметром капилляра несколько десятых миллиметра) вязкость крови в 4 – 5 раз выше вязкости воды. Это отношение вязкости крови к вязкости воды называют относительной вязкостью крови. Вязкость крови зависит многих факторов, в том числе от вязкости плазмы крови, которая в свою очередь определяется концентрацией белков.
Литература
1. Садовничая Л.Г., Биофизическая химия, М., Просвещение, 1985
2. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. Москва, "Высшая школа", 1990 г.
3. Чернобельская Г.М., Чертков И.Н. Химия (для медучилищ), М., Медицина, 1991
4. Общая химия. Биофизическая химия. Химия биогенных элементов. Пол ред. Ю.А.Ершова - Москва, Высшая школа, 1993 г.
5. Рудзитис Г.Е., Фельдман Ф.Г., Химия 11 кл, Просвещение, 2014
 2015-01-07
2015-01-07 5533
5533







