Основные виды коррозии бетона можно свести в три группы:
- разложение цементного камня водой, а также растворение и вымывание образующейся при этом Са(ОН)2. Растворимость гидроксида кальция может увеличиваться или уменьшаться в зависимости от содержания примесей в воде в соответствии с правилом произведения растворимости;
- образование легко растворимых солей в результате взаимодействия составляющих цементного камня с веществами, находящимися в окружающей среде, и вымывание этих солей. Особое практическое значение имеют коррозии – углекислая и магнезиальная.
Углекислая коррозия обуславливается наличием в большинстве природных вод двуокиси углерода. Вода, в которой растворенная СО2 и ионы Н+, НСО3, СО32- находятся в равновесии, не способна растворить карбонатную пленку бетона. Увеличение количества СО2 в воде приводит к растворению карбонатной пленки по реакции:
СаСО3 +2Н+ +СО32- = 2Са(НСО3)2
Избыточная (сверх равновесного количества) двуокись углерода (агрессивная СО2) вызывает углекислую коррозию цементного камня.
|
|
|
Магнезиальная коррозия вызывается содержащимися в морской воде и грунтовых водах солями магния (MgSO4, MgCl2)
MgSO4 + Ca(OH)2 = CaSO4 + Mg(OH)2
Цемент.камень
MgCl2 + Ca(OH)2 = CaCl2 + Mg(OH)2
Цемент.камень
При действии магнезиальных солей образуются наряду с гидроксидом магния (рыхлая, пронизаемая для воды пленка) хлорид и сульфат кальция. СаCl2 повышает растворимость извести и, следовательно, ускоряет коррозионные процессы.
Сульфатная коррозия обуславливается накоплением в порах и капиллярах бетона соединений, имеющих больший объем, чем исходные продукты реакции.
Сульфаты встречаются в большинстве природных вод, а также в сточных водах.
В результате обменных реакций с цементным камнем, вода, с ним соприкасающаяся, постепенно насыщается сульфатом кальция. Сульфат кальция может далее взаимодействовать с гидроалюминатом кальция. При этом получается высокосульфатная форма гидросульфоалюмината кальция
3CaO∙ Al2O3∙3CaSO4∙31(32)H2O, образующаяся с большим увеличением объема, т.к. она кристаллизуется с 31-32 молекулами воды. Рост ее кристаллов вызывает разрушение цементного камня и бетона.
Методы защиты бетона и других материалов от коррозии можно свести в следующие группы:
- выбор цемента, по отношению к которому данная среда не являлась бы агрессивной. Так, например, во избежание сульфатной коррозии необходимо использовать сульфатостойкий портландцемент (с пониженным содержанием трехкальциевого алюмината - не более 5%). Для эксплуатации коррозионного действия только мягкой воды используют цемент с 30-50% активной минеральной добавки – пуццолановый портландцемент;
|
|
|
- изготовление особо плотного цемента, т.к. иначе облегчается диффузии агрессивных жидкостей в тело бетона. Для этой цели применяются пластифицирующие поверхностно - активные добавки.
- применение защитных покрытий и облицовок, практически исключающих воздействие агрессивной среды на бетон.
Пример 1. Определение массы воды по уравнению реакции
Для получения пушонки к негашеной извести добавили воду, масса которой составляет 96,4% массы исходной извести. Во сколько раз масса использованной воды превышает массу воды, которая необходима по уравнению реакции гашения?
Решение. СаО + Н2О = Са(ОН)2
М(СаО) = 56 г/моль; М(Н2О) = 18 г/моль;
1. Допустим, что негашеная известь – чистый гидроксид кальция и количество извести для гашения составляет 1 моль. Следовательно, масса извести равна: m(СаО) = 1 моль∙56 г/моль = 56 г.
2. Масса использованной воды: m(Н2О) = 56 ∙ 0,964 = 54 г.
3. Из уравнения реакции гашения видно, что для получения пушонки количество требуемой воды составляет 1 моль, следовательно, по массе 18 г Н2О.
4. Находим отношение массы использованной воды к массе требуемой по уравнению реакции:
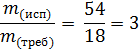
Ответ: в 3 раза.
Пример 2. Определение степени чистоты гипса
Определить степень чистоты гипса, если при нагревании до 1200С образца минерала массой 20 г. потеря массы составила 2,83 г (примесь воду не содержит).
Решение. Масса природного гипса уменьшается за счет частичной дегидратации:
СаSO4∙2Н2О → СаSO4∙0,5Н2О + 1,5 Н2О↑
М(СаSO4∙2Н2О) = 172 г/моль
М(Н2О) = 18 г/моль
По уравнению реакции: на 172 г СаSO4∙2Н2О потеря воды составит 27 г.
По условию задачи находим массу чистого гипса без примесей:
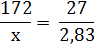
Находим степень чистоты гипса (содержание СаSO4∙2Н2О):
С%(чист) = 18∙100/20 = 90%
Ответ: степень чистоты гипса составляет 90%.
Пример 3. Определение объема кислоты
Сколько (мл) соляной кислоты массовой доли 36,5 % и плотностью 1,2 г/мл потребуется для взаимодействия оксида кальция, который содержится в цементном порошке массой 40 г, если на долю оксида кальция приходится 58%.
Решение. По уравнению реакции:
СаО + 2 НCl = СаСl2 + Н2О
1 моль 1 моль
M(CаО) = 56 г/моль
М(HCl) = 36,5 г/моль
1. Находим массу оксида кальция в цементном порошке:
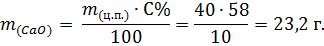
2. Находим массу соляной кислоты:
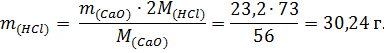
3. Находим объем соляной кислоты из формулы:
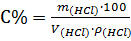 ,
,
где 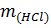 – масса HCl;
– масса HCl;
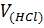 – объем HCl (р-р);
– объем HCl (р-р);
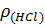 – плотность HCl (р-р);
– плотность HCl (р-р);
С% – процентная концентрация раствора соляной кислоты.
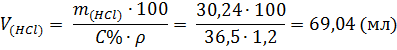
Ответ: потребуется 69,04 мл соляной кислоты.
Пример 4. Определение массы воды
В состав цементного клинкера входит алит (трехкальциевый силикат) 3СаО∙SiO2, который при схватывании связывает 3 моль воды. Определить массу воды, которую необходимо добавить к клинкеру для твердения алита, если масса портландцементного клинкера составляет 100 г, содержание в клинкере алита 48%.
Решение. Уравнение реакции схватывания алита:
3СаО∙SiO2 + 3Н2О = Са(ОН)2 + 2CaO∙SiO2∙2H2O
М(3СаО∙SiO2) = 228 г/моль
М(Н2О) = 18 г/моль
1. Находим массу алита в клинкере:
m(алита) = 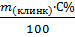 , где
, где
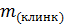 – масса клинкера;
– масса клинкера;
m(алита) – масса алита;
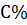 - процентное содержание алита в клинкере.
- процентное содержание алита в клинкере.
m(алита) = 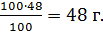
2. Находим массу воды по формуле:
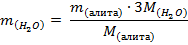
где 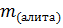 – масса алита;
– масса алита;
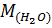 – молярная масса воды;
– молярная масса воды;
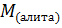 – молярная масса алита.
– молярная масса алита.
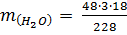 = 11,37 г.
= 11,37 г.
Ответ: масса воды составляет 11,37 г.
Пример 5. Определение массы кристаллической соды
Сколько (кг) кристаллической соды Na2CO3∙10H2O потребуется для приготовления силикат-глыбы Na2O∙2,67SiO2 массой 11,1 кг, если на 1 моль соды при спекании расходуется 2,67 моль SiO2
Решение. Уравнение реакции спекания соды с кварцевым песком:
Na2CO3∙10H2O + 2,67 SiO2 = Na2O∙2,67SiO2 + CO2↑ + 10H2O↑
силикат-глыба
М(силикат-глыбы) = 222 г/моль
М(крист. соды) = 286 г/моль
По уравнению реакции:
На 222 г силикат-глыбы требуется 286 г соды.
Находим массу кристаллической соды, которая требуется для получения силикат-глыбы по уравнению
|
|
|
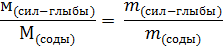
где 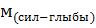 – молярная масса силикат-глыбы;
– молярная масса силикат-глыбы;
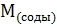 – молярная масса соды;
– молярная масса соды;
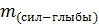 – масса силикат-глыбы;
– масса силикат-глыбы;
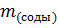 – масса соды.
– масса соды.
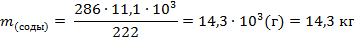
Ответ: Масса соды составляет 14,3 кг.
 2015-01-13
2015-01-13 2878
2878
