a) Окислительно-восстановительное титрование.
о-в титрование основано на реакциях окисления-восстановления. Для количественного анализа подходят реакции, которые протекают быстро и количественно (практически до конца). По стехиометрии (в соответствии с уравнением реакции с расставленными коэффициентами) и позволяют фиксировать точку эквивалентности.
Рабочими растворами метода служат растворы окислителей и восстановителей. Чаще употребляют растворы окислителей, в связи с их большей устойчивостью.
Виды о-в титрования называются по применяемому рабочему раствору.
KMnO4 -перманганатометрия
I2 -йодометрия
KBrO3 -бромадометрия
Br2 -бромометрия
K2Cr2O4 -бихроматометрия (дихроматометрия)
NaNO2 -нитритометрия
Ce(SO4) –цериметрия
b) Индикаторы для о-в титрования.
Для определения точки эквивалентности применяют инструментальные и индикаторные способы. В индикаторных способах используют обратимые о-в индикаторы, специфические и необратимые.
Обратимые изменяют свой цвет если изменяется о-в-й потенциал системы. Эти потенциалы всегда изменяются, если в растворе происходит о-в реакция.
Необратимые индикаторы – красители, которые необратимо обесцвечиваются при действии окислителей (метилоранж).
c) Кривые о-в титрования.
Для построения кривых о-в титрования рассчитывают по уравнению Нернста о-в-й потенциал системы.
|
|
|
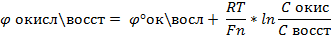
n – число е(сверху черта), которые переходят от восстановителя к окислителю в уравнении.
С – конц. (при точных вычислениях – активность)
При стандартной t=25С, получаем уравнение Нернста.
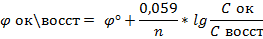
13. Перманганатометрия.
а) Метод основан на реакции окисления с участием перманганат-ионов. Окисление может проводиться как в кислой, так и в нейтральной и щелочной среде. При восстановлении KMnO4 ведёт себя по разному в кислой, нейтральной и щелочной средах.
В кислой среде обесцвечивается. (р-я)
В нейтральной и щелочной: (р-я)
Окислительная способность KMnO4 в кислой среде гораздо выше чем в нейтральной или щелочной. При титровании в кислой среде образуются бесцветные ионы Mn2+, а в щелочной или нейтральной выпадает бурый осадок MnO2, который затрудняет титрование. Поэтому чаще используют реакции окисления в кислой среде.
б ) Рабочий раствор метода - раствор KMnO4 . В реакциях легко восстанавливается различными органическими веществами, которые присутствуют в воздухе и в воде. Р-р KMnO4 готовят за неделю до использования, хранят в склянке из тёмного стекла, затем устанавливают точную концентрацию KMnO4 либо по щавелевой кислрте, либо по её соли (оксалату Na).
в) Индикатор метода.
Титрование KMnO4 проводят без индикатора, т. к. 1избыточная капля KMnO4 окрашивает бесцветный титруемый раствор в розовый цвет.
г) Применение.
Для анализа химических соединений, обладающих восстановительными свойствами. С помощью KMnO4 определяют содержание в растворе H2O2 (перекись водорода), Fe2+ , NaNO2, содержание органических веществ в воде(перманганатная окисляемость воды).
|
|
|
14. Йодометрия.
Иодометрия — титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления-восстановления (разновидность оксидиметрии) с участием иода или иодида калия:
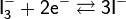
Прямое иодометрическое титрование непосредственно раствором I2 может быть использовано, в частности, для титрования восстановителей в присутствии избытка KI:
Этим способом определяют концентрацию As(III), Sn(II), Sb(III), сульфидов, сульфитов, тиосульфатов и др.:
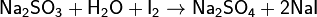
Возможно также определение восстановителей с избытком иода, непрореагировавшее количество которого определяется титрованием тиосульфата натрия.
Косвенное иодометрическое титрование используется для титрования окислителей; в этом случае определяемые вещества взаимодействуют с избытком KI с образованием иода, который оттитровывается раствором тиосульфата натрия. Этот способ используется для определения концентрации Cu(II), H2O2, Br2, BrO3-, ClO-
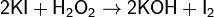
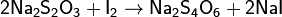
Иодометрический метод анализа используется также для определения концентрации ионов H+:
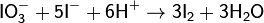
Иодометрический метод анализа является также основой метода Фишера по определению воды в органических растворителях.
Определение конечной точки титрования
Наиболее распространённым индикатором для определения конечной точки титрования служит крахмал, который образует с иодом ярко окрашенный аддукт фиолетового цвета. Другими индикаторами служат кумарин, производные α-пирона. Конечную точку титрования определяют также при помощи физико-химических методов анализа — потенциометрически, амперометрически и др.
Погрешности в определении конечной точки титрования связаны с летучестью иода, возможностью изменения концентрации иодида калия вследствие его окисления кислородом воздуха, разложения тиосульфата натрия в кислой среде или протекания реакции тиосульфата натрия с иодом в щелочной среде по иному механизму реакции.

 2015-01-21
2015-01-21 6817
6817








