Внутренняя энергия. Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, нахо- дящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Чайник с водой, находящийся на газовой плите, нагрева- ется. Предметы, имеющие разную температуру, при сопри- косновении приходят к состоянию, когда их температуры выравниваются. Причем более теплое тело становится хо- лодней, а холодное нагревается. С давних времен ученые пы- тались понять, что такое тепло и как можно его использовать в своих целях. Много тысяч лет назад наши предки добывали огонь трением друг о друга двух деревянных предметов. Не осознавая этого, они в результате трения превращали меха- ническую работу в теплоту, которая приводили к возгоранию деревянных предметов.
Теплота Q – это энергия, которая переходит от одного тела к другому между телами с разной температурой или, другими словами, мера переноса энергии от одного тела к другому при разнице температур.
|
|
|
Следует различать понятия теплоты и внутренней энер- гии. Под внутренней или тепловой энергией W понимают полную сумму всех видов энергии всех молекул, принадле- жащих телу. Она включает в себя кинетическую энергию по- ступательного движения молекул, потенциальную энергию их взаимодействия, энергию межатомных и межмолекуляр- ных связей, наличие вращательных и колебательных степе- ней свободы у атомов и молекул. Таким образом, она вклю- чает все виды энергии поступательного, вращательного и ко- лебательного движения частиц, а также их взаимную потен- циальную энергию. Температура характеризует только часть внутренней энергии тела. Под температурой T понимают среднюю кинетическую энергию всех молекул.
Теплоемкость. Экспериментально установлено, что ко- личество теплоты, получаемое телом, пропорционально его массе и изменению его температуры. Теплоемкостью тела С называется величина, характеризующая данное вещество, и
численно равная количеству теплоты Q, которое необходимо сообщить для нагревания вещества массой m:
Q = C Δ T. (2.2.1)
Удельной теплоемкостью вещества называется теплоемкость единицы массы вещества:
откуда
c = C, (2.2.2)
 m
m
Q = cm Δ T.. (2.2.3)
Наиболее высокой удельной теплоемкостью из всех веществ обладает вода – 4184 Дж/кг × град. Она выше теплоемкости железа в ~ 9 раз.
Теплоемкость характеризует способность тела накапли- вать в себе определенное количество теплоты. Об уровне те- плопередачи белка можно судить, если взять только что сва- ренное яйцо. Если его опустить в холодную воду и подер- жать некоторое время, а затем вынуть, то оно вначале будет холодным, а потом вновь станет горячим. Если в холодную воду опустить чайную ложку, то ее температура быстро ста- нет такой же, как у воды. Другие предметы, например, стек- ло, фарфор, в аналогичном случае также быстро станут хо- лодными.
|
|
|
Первое начало термодинамики было сформулировано в середине XIX в. немецким физиком Клаузиусом в 1854 г. Оно формулируется следующим образом: количество тепло- ты, полученное системой, идет на приращение ее внутренней энергии и на совершение работы против внешних сил:
Δ Q = Δ U + Δ A. (2.2.4)
Первое начало термодинамики представляет собой закон сохранения механической и тепловой энергии при их взаи- мопревращениях. Отсюда стало понятно, что закон сохране- ния энергии должен носить всеобщий характер, сохраняясь при переходах энергии из одной формы в другую для всех видов энергий. Последующее развитие физики успешно под- твердило этот вывод экспериментально на атомном и ядер- ном уровнях, во всех взаимопревращениях элементарных частиц.
Тепловой двигатель. КПД. Любой равновесный про- цесс называется обратимым, если термодинамическую сис- тему можно вернуть из конечного состояния в начальное со- стояние, проходя через всю последовательность состояний в обратном порядке. Можно привести бесконечное количество примеров существования необратимых процессов в природе. Так камень, падая с некоторой высоты, передает свою потен- циальную энергию в теплоту песка, в котором он застревает. Обратное, когда тепло Земли сконцентрируется в энергии камня, а затем превратится в кинетическую энергию камня, который взлетит вверх, невозможно. Хотя именно об этом мечтал барон Мюнхгаузен. Можно смешать соль и сахар, на- сыпанные слоями в кружке, обратно, сколько не трясите кружку, их разделить не удастся. Подобного рода процессы не нарушают первого начала термодинамики.
Отсутствие обратимости ряда термодинамических про- цессов привело к формулировке второго начала термодина- мики, которое указывает на направленность термодинамиче- ских процессов. Примером таких процессов могут служить необратимые процессы, которые идут с конечной постоян- ной скоростью.
В 1865 году формулировка второго начала термодина- мики звучала следующим образом: теплота в естественных условиях переходит от горячего тела к холодному, в то время как от холодного тела к горячему теплота сама по себе не пе- реходит.
Трудно представить, чтобы газ, заполняющий баллон, был выпущен в помещении, а затем он самопроизвольно со- брался вновь в баллоне. Или, например, воздух в комнате са- мопроизвольно разделился бы на кислород, азот и углекис- лый газ даже в очень маленьком объеме.
Формулировка второго начала термодинамики разраба- тывалась в экспериментальных исследованиях тепловых дви- гателей. Тепловым двигателем 13называют устройство, кото- рое переводит теплоту в механическую работу.

13 Первый тепловой двигатель был создан в 1774 г. английским изобретателем Д. Уаттом. До него пароатмосферная машина была
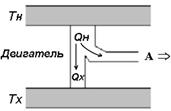
 Физическая идея, лежащая в основе работы теплового двигателя, заключается в том, что часть тепла, переходящего от горячего тела к холодному можно превратить в механиче- скую работу. Условиями работы любого теплового двигателя являются периодичность процесса, наличие рабочего тела, нагревателя и холодильника. Температуры нагревателя Т ни холодильника Т хназываются рабочими температурами теп- лового двигателя. Рабочим телом парового двигателя назы- вается вещество (как правило, пар или горючие вещества), которое нагревается и затем, охлаждаясь, часть своего тепла превращает в работу. Схема теплового двигателя представ- лена на рис. 2.9, а. Часть тепла Q нот нагревателя передается рабочему телу и превращается в механическую работу, дру- гая часть Q хвозвращается холодильнику.
Физическая идея, лежащая в основе работы теплового двигателя, заключается в том, что часть тепла, переходящего от горячего тела к холодному можно превратить в механиче- скую работу. Условиями работы любого теплового двигателя являются периодичность процесса, наличие рабочего тела, нагревателя и холодильника. Температуры нагревателя Т ни холодильника Т хназываются рабочими температурами теп- лового двигателя. Рабочим телом парового двигателя назы- вается вещество (как правило, пар или горючие вещества), которое нагревается и затем, охлаждаясь, часть своего тепла превращает в работу. Схема теплового двигателя представ- лена на рис. 2.9, а. Часть тепла Q нот нагревателя передается рабочему телу и превращается в механическую работу, дру- гая часть Q хвозвращается холодильнику.
|
|
|
а б
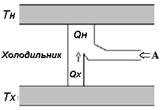
Рис. 2.9. Схема работы теплового двигателя (а) и холодильника (б)
Принцип действия обратного устройства – холодильника заключается в обращении стадий работы теплового двигате- ля. На рис. 2.9, б видно, что, совершая работу, можно отнять часть тепла у холодного тела. Это осуществляется, когда ис- пользуемый в качестве рабочего тела газ – фреон нагревается в холодильнике. Затем он поступает в компрессор, который с помощью мотора выбрасывает его в конденсатор, работаю- щий при комнатной температуре. Там часть тепла передается окружающей среде, а затем разряженный газ вновь попадает в холодильник. В обычном холодильнике газ фреон движется по трубкам внутри холодильника, отбирая из него тепло.

изобретена русским механиком И.И. Ползуновым. Однако машина проработала недолго, а затем была разобрана.
Затем тепло передается металлическому радиатору, который охлаждается под действием воздуха. Этот процесс происхо- дит периодически. Если температура в холодильнике стала слишком низкой, то он на некоторое время отключается. Мы хорошо знаем, что со стороны задней стенки холодильника всегда теплее, чем в комнате, где он находится.
Эффективность работы любого двигателя определяется его коэффициентом полезного действия (КПД) η – отноше- нием полезной работы теплового двигателя А к затраченной теплоте Q:
или
h = А (полезная работа), (2.2.5)
Q (затраченная теплота)
 h = Q н- Q х
h = Q н- Q х
Q н
. (2.2.6)
Для повышения КПД двигателя необходимо повышать тем- пературу нагревателя Q н, либо понижать температуру холо- дильника Q х. Температуру нагревателя ограничивает проч- ность материалов, из которых построен двигатель, а темпе- ратура холодильника не может быть ниже температуры ок- ружающей среды. Поскольку, как показал эксперименталь- ный опыт, температура холодильника Т х не может быть рав- на абсолютному нулю и всегда больше нуля, КПД любого двигателя всегда меньше единицы, η < 1. Если бы температу- ру холодильника можно было бы уменьшить по сравнению с
|
|
|
температурой окружающей среды до абсолютного нуля, то создание идеального двигателя с КПД = 100%14оказалось бы возможным.
Невозможность создания идеального теплового двигате- ля представляет другой вариант формулировки второго на- чала термодинамики: невозможен периодический процесс, единственным результатом которого было бы преобразова- ние полученного от нагревателя тепла полностью в работу.

14 Французская академия наук с 1775 г. не принимала на рассмот- рения проекты создания вечных двигателей.
Энтропия является параметром состояния системы, по- скольку зависит от состояния системы и не зависит от про- цесса, посредством которого эта система пришла в это со- стояние. По смыслу энтропия S напоминает потенциальную энергию, поскольку для нее неизвестно абсолютное значе- ние, интерес представляет лишь ее изменение. Математиче- ски для обратимых процессов она описывается выражением
 dS = dQ
dS = dQ
T.
(7.5.2)
Понятие энтропии было введено австрийским ученым Л. Больцманом15. Для понимания смысла термодинамиче- ской вероятности приведем пример с двумя кубиками с про- нумерованными сторонами. В сумме на них может выпасть от 2 до 12. Наиболее вероятным числом будет 7, поскольку
оно может быть получено наибольшим числом способов
(шестью): 1 + 6 = 2 + 5 = 3 + 4 = 4 + 3 = 5 + 2 = 6 + 1. Количе-
ство комбинаций представляет термодинамическую вероят- ность макросостояния.
Это можно понять на примере. Из воздуха в изолирован- ной комнате нам необходимо выделить какую-то состав- ляющую, например, газ СО2и собрать ее в одной из половин комнаты. Термодинамическая вероятность того, что это про- изойдет самопроизвольно, равна вероятности того, что моле- кулы данной примеси одновременно окажутся в одной поло- вине. Интуитивно понятно, что эта вероятность ничтожна мала.
С использованием понятия энтропии второе начало тер- модинамики формулируется следующим образом: полная энтропия произвольной системы вместе с ее окружением в любом естественном процессе увеличивается: Δ S ≥ 0.
Такая формулировка представляет собой наиболее общее определение второго начала термодинамики. Она характери- зует направленность процессов в природе. Энтропия описы-

15 После смерти Л. Больцмана на его могиле выгравировали опре- деление энтропии, введенной им как связь микро- и макромира S = k log Г, где k – постоянная Больцмана, Г – статистический
вес состояния системы.
вает переход от порядка к хаосу. Чем выше степень беспо- рядка, тем выше энтропия системы. Таяние льда или пре- вращение в пар воды приводит к возрастанию энтропии, по- скольку степень беспорядка в системе возрастает. Жизнь и смерть. Живой организм – это сильно упорядоченная струк- тура. После смерти он превращается в набор атомов и моле- кул, т.е. степень беспорядка в системе возрастает. Все при- меры показывают естественное возрастание энтропии. Чтобы она уменьшалась, необходимо совершать работу.
 2015-01-21
2015-01-21 724
724








