| Масса цинка m (Zn), г | Объем выделившегося водорода V, л | Условия опыта | Масса водорда m (H2), г | Молярная масса эквивалентов цинка | |||
| Температура Т, К | Давление атмсферн. Р 1, кПа | Давл. водян. пара Р 2, кПа | практич. М эк,пр.(Zn), г/моль | теоретич. М эк,т.(Zn), г/моль | |||
Вычислить (все вычисления пояснить словами):
1. Массу выделившегося объема водорода, пользуясь уравнением Менделеева – Клапейрона: 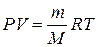 , откуда
, откуда 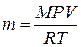 ,
,
где P – парциальное давление водорода, кПа; V – объем выделившегося водорода, л; m – масса водорода, г; M – молярная масса водорода, г/моль; Т – температура опыта, К; R – универсальная газовая постоянная, равная 8,314 Дж/(моль·К).
В нашем опыте водород собирается над водой, содержит водяной пар, поэтому для вычисления парциального давления водорода нужно из величины атмосферного давления вычесть величину давления насыщенного водяного пара при температуре опыта (табл. 2.2 ): Р = Р 1 – Р 2.
2. Молярную массу эквивалентов цинка М эк.пр.(Zn) по закону эквивалентов: 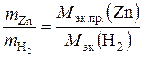 .
.
|
|
|
3. Теоретическое значение молярной массы эквивалентов цинка М эк,т.(Zn):
М эк,т.(Zn) = 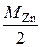 .
.
4. Относительную ошибку опыта Е (%):
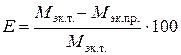 .
.
Таблица 2.2
 2014-09-04
2014-09-04 1457
1457








