Обозначим концентрации реагирующих веществ:
[SO2] = а, [O2] = b, [SO3] = c. Согласно закону действия масс скорости и прямой и обратной реакций до изменения объема можно рассчитать по уравнениям:
Vпр = k ∙a2·b;
Vобр = k1 ∙с2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3a, [O2] = 3b, [SO3] = 3с
При новых концентрациях скорости V’ прямой и обратной реакции рассчитывается по формулам
V'пр = k·(3a)2·(3b) = 27·k·a2·b;
V'обр= k1·(3с)2 = 9·k1·с2.
Отсюда
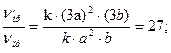
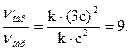
Следовательно, скорость прямой реакции увеличится в 27 раз, а обратной – только в 9 раз. Равновесие системы сместится в сторону образования серного ангидрида (SO3).
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
 2015-02-24
2015-02-24 415
415








