Дисперсные системы и коллоидно-химические процессы имеют место как в пищевой промышленности, так и в общественном питании. Коллоидно-химические процессы, такие как набухание, растворение, студнеобразование, агрегация, коагуляция, осаждение, пептизация, адсорбция, лежат в основе производства многих пищевых продуктов: бульонов, мороженого, различных кондитерских изделий, молочных продуктов, а также в основе хлебопечения, виноделия, пивоварения. Масло, маргарин, майонез, сметана, сливки, молоко, представляют собой сложные коллоидные системы. Для осуществления управления технологическими процессами производства пищевых продуктов инженерам-экономистам необходимо знание характеристик дисперсных систем и их основных свойств.
Дисперсными системами называют системы, состоящие из вещества, раздробленного до частиц большей или меньшей величины, и распределенного в другом веществе. Одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2-0,1 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1 мм до 400-300 нм*, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии. Между миром молекул и микроскопически видимых частиц находится область раздробленности вещества с комплексом новых свойств, присущих этой форме организации вещества. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400-300 нм до 1 нм - коллоидным состоянием вещества.
Дисперсные системы состоят из сплошной непрерывной фазы - дисперсионной среды, в которой распределены раздробленные частицы, и находящихся в этой среде самих раздробленных частиц того или иного размера и формы - дисперсной фазы. Дисперсные системыявляются гетерогенными, т.е. для них характерно существование реальных физических поверхностей раздела фаз между дисперсионной фазой и дисперсной средой.
Обязательным условием получения дисперсных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Например, нельзя получить коллоидные растворы сахара или поваренной соли в воде, но они могут быть получены в керосине или в бензоле, в которых эти вещества практически нерастворимы.
Количественной характеристикой дисперсности (раздробленности) вещества является степень дисперсности (степень раздробленности, D) - величина, обратная размеру (а) дисперсных частиц:
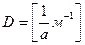
Здесь а равно либо диаметру сферических или волокнистых частиц, либо длине ребра кубических частиц, либо толщине пленок (рис.1). Чем меньше размеры частиц, тем больше дисперсность, и наоборот.
* 1 нм (нанометр) = 10 –6 мм.
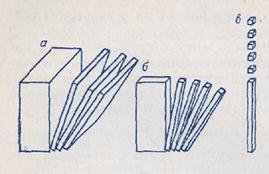 | Рис. 1. Одно-, двух- и трехмерное диспергирование вещества приводит к образованию пленочно (а), волокнисто (б) и корпускулярно-дисперсных (в) систем. |
Частицы коллоидных систем состоят из большого числа молекул и являются отдельной фазой. Молекулы среды, в которой распределены коллоидные частицы, образуют другую фазу. Молекулы вещества дисперсной фазы, находящиеся на поверхности коллоидных частиц, обладают потенциальной энергией и с увеличением дисперсности, а значит, с увеличением удельной поверхности, возрастает и поверхностная энергия системы. Известно, что все системы, обладающие избыточной поверхностной энергией, неустойчивы. Следовательно, коллоидные системы, обладающие большой удельной поверхностью и большой поверхностной энергией, являются принципиально неустойчивыми системами. Они всегда стремятся к самопроизвольному уменьшению своей свободной энергии либо за счет сокращения межфазной поверхности, т.е. снижения дисперсности, либо за счет адсорбции коллоидными частицами веществ, понижающих поверхностную энергию.
Дисперсные системы классифицируют по дисперсности, агрегатному состоянию дисперсной фазы и дисперсионной среды, интенсивности взаимодействия между ними, отсутствию или образованию структур в дисперсных системах и др.
В табл. 2 приведены условно принятые границы размеров частиц систем с различной раздробленностью вещества.
Таблица 2 - Классификация корпускулярно-дисперсных систем по степени дисперсности
| Системы | Раздробленность вещества | Поперечник частиц, см | Степень дисперсности D, см-1 |
| Грубодисперсные | Макроскопическая | 10-2-10-4 | 102-104 |
| Микроскопическая | 10-4-10-5 | 104-105 | |
| Предельно-высокодисперсные | Коллоидная | 10-5-10-7 | 105-107 |
| Молекулярные и ионные | Молекулярная и ионная | 10-7-10-8 | >107 |
Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы называют монодисперсными (рис. 2, а и б). Частицы дисперсной фазы неодинакового размера образуют полидисперсные системы (рис.2, в).
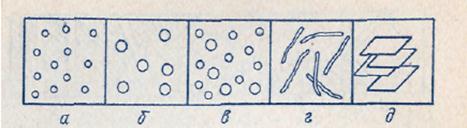
Рис. 2. Свободнодисперсные системы: корпускулярно-(а-в), волокнисто-(г) и пленочно-дисперсные-(д); а, б - монодисперсные; в-полидисперсная система.
При уменьшении размеров и повышении дисперсности возрастает характерная для всяких гетерогенных систем внутренняя поверхность раздела между фазами, все большее и большее число атомов вещества находится в поверхностном слое (на границе раздела фаз) по сравнению с их числом внутри объема частиц дисперсной фазы, т.е. заметнее роль граничных слоев и связанных с ними поверхностных явлений.
Таким образом, своеобразие дисперсных систем определяется большой удельной поверхностью дисперсной фазы и физико-химическим взаимодействием дисперсной фазы и дисперсионной среды на границе раздела фаз. В табл. 3 приведены отличительные особенности коллоидных систем в сравнении с истинными растворами и грубодисперсными системам.
Таблица 3 – Характеристика дисперсных систем
| Свойства частиц | Грубодисперсные системы (суспензии и эмульсии) | Коллоидные системы | Истинные растворы |
| Размеры | 10-2 -10-5 см | 10-5-10-7 см | 10–7 см и менее |
| Диффузия | Отсутствует | Очень слабо выражена | Хорошо выражена |
| Фильтрация | Частицы не проходят через бумажный фильтр | Частицы проходят через бумажный фильтр | Частицы (молекулы) проходят через бумажный и ультрафильтры |
| Проходимость через мембрану | Не проходят | Не проходят | Проходят |
| Видимость в обычном микроскопе | Видимы | Невидимы | Невидимы |
| Видимость в ультрамикроскопе | Видимы | Обнаруживаются | Невидимы |
| Видимость в электронном микроскопе | Видимы | Видимы | Видимы только наиболее крупные молекулы |
| Поверхностная энергия | Проявляется слабо | Проявляется | Отсутствует |
Многообразие дисперсных систем обусловлено также тем, что образующие их фазы могут находиться в любом из трех агрегатных состояний. При схематической записи агрегатного состояния дисперсных систем обычно используют дробь: в числителе указывают буквами Г (газ), Ж (жидкость) или Т (твердое) агрегатное состояние дисперсной фазы, а в знаменателе указывают агрегатное состояние дисперсионной среды.
Таблица 4 – Классификация дисперсионных систем по агрегатному состоянию
| Дисперсионная среда | Дисперсная фаза | ||
| газ | жидкость | твердое тело | |
| Газ | - | Аэрозоль (туман, облако) | Аэрозоль (дым, пыль) |
| Жидкость | Пена (мыльная пена) | Эмульсия (масло сливочное, маргарин, кремы) | Суспензия (молоко) и коллоидные растворы |
| Твердое тело | Пористые и капиллярные системы (пемза, пенолпласты) | Пористые тела, гели (вода в парафине, жемчуг) | Твердые коллоидные растворы (окрашенные стекла, сплавы) |
В связи с неограниченной взаимной растворимости газов дисперсионные системы Г/Г при классификации обычно не указывают.
Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой (Ж/Г), а пыль и дым - аэрозоли с твердой дисперсной фазой (Т/Г).
Пены - это дисперсия газа в жидкости (Г/Ж), причем в пенах жидкость вырождается до тонких пленок, разделяющих отдельные пузырьки газа. Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой, нерастворяющей ее жидкости (Ж/Ж). Низкодисперсные системы твердых частиц в жидкостях (Т/Ж) называют суспензиями, или взвесями, а предельно-высокодисперсные - коллоидными растворами, или золями.
В твердой дисперсионной среде могут быть диспергированы газы, жидкости или твердые тела. К системам (Г/Т - пористые и капиллярные системы или твердые пены) относятся пенопласты, пенобетон, пемза, шлак, металлы с включением газов. Как своеобразные твердые пены можно рассматривать и хлебобулочные изделия. В твердых пенах газ находится в виде отдельных замкнутых ячеек, разделенных дисперсионной средой. Примером системы (Ж/Т) является натуральный жемчуг, представляющий собой карбонат кальция, в котором коллоидно-диспергирована вода.
Дисперсные системы могут быть свободнодисперсными (рис. 2) и связнодисперсными (рис. 3, а - в) в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, разбавленные суспензии и эмульсии. Они текучи, в этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Связнодисперсные системы - твердообразны; они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки. Такая структура ограничивает текучесть дисперсной системы и придает ей способность сохранять форму. Порошки, концентрированные эмульсии и суспензии (пасты), пены, гели – примеры связнодисперсных систем. Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярно-дисперсные системы (кожа, картон, ткани, древесина).
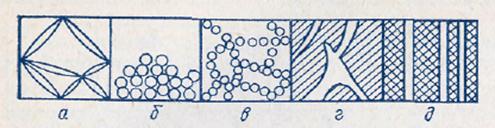
Рис. 3. Связнодисперсные (а-в) и капиллярно-дисперсные (г, д) системы: гель (а), коагулянт с плотной (б) и рыхлой – арочной (в) структурой.
Дисперсные системы, в соответствии с их промежуточным положением между миром молекул и крупных тел, могут быть получены двумя путями: методами диспергирования, т. е. измельчения крупных тел, и методами конденсации молекулярно- или ионнорастворенных веществ.
Метод конденсации состоит в получении нерастворимых соединений путем химических реакции. Проводя эти реакции в сильно разбавленных растворах и в присутствии небольшого избытка одного из компонентов, получают не осадки, а коллоидные растворы.
 2015-02-24
2015-02-24 12436
12436
