1. Термодинамическая система – совокупность макроскопических объектов (физических тел), обменивающихся тепловой энергией между собой и окружающей средой.
2. Состояние термодинамической системы определяется совокупностью значений ее термодинамических параметров (параметров состояния) – всех физических величин, характеризующих макроскопические свойства системы (давление, объем, температура и др.). Связь между термодинамическими параметрами определяется уравнением состояния. Так, для идеального газа уравнение состояния – это уравнение Менделеева-Клапейрона.
3. Состояние термодинамического равновесия есть обобщение понятия механического равновесия и формулируется следующим образом: в системе, находящейся в термодинамическом равновесии, должны быть равны давления во всех ее частях (условие механического равновесия) и температуры (условия термического равновесия).
4. Термодинамический процесс – изменение состояния термодинамической системы, характеризующееся изменением ее параметров состояния; бесконечная последовательность состояний равновесия.
|
|
|
5. Внутренняя энергия – суммарная кинетическая и потенциальная энергия взаимодействия всех частиц (в термодинамике это атомы или молекулы) тела.
Для идеального газа потенциальной энергией взаимодействия молекул можно пренебречь, поэтому внутренняя энергия идеального газа полностью определяется энергией всех его молекул, находящихся в некотором ограниченном объеме. Внутренняя энергия идеального газа может быть найдена как произведение средней кинетической энергии 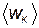 движения молекул на их число. Поскольку
движения молекул на их число. Поскольку 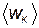 зависит лишь от температуры (8.12), то можно утверждать, что внутренняя энергия идеального газа полностью определяется его температурой.
зависит лишь от температуры (8.12), то можно утверждать, что внутренняя энергия идеального газа полностью определяется его температурой.
В реальном газе необходимо учитывать потенциальную энергию взаимодействия молекул, которая зависит от расстояния между ними (а значит и от объема V). Поэтому внутренняя энергия реального газа есть однозначная функция от температуры и объема. В общем случае говорят, что внутренняя энергия является функцией состояния и определяется этой функцией однозначно.
6. Работа есть количественная мера превращения энергии хаотического движения молекул или направленного движения тел в энергию направленного движения макроскопических тел. Схематически такой процесс превращения энергии показан на рис. 9.1.
Процесс 1 сопровождается выполнением механической работы, которая численно равна изменению кинетической энергии тела (3.10).
Рис. 9.2
Рассмотрим пример, в котором иллюстрируется протекание процесса 2 (рис. 9.2). При расширении газа энергия хаотического движения молекул переходит в энергию поступательного (направленного) движения поршня, за счет чего совершается работа. Если поршень переместился на расстояние dx, то элементарная работа
|
|
|
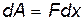 , ,
|
где F=PS – сила давления газа на поршень сечением S.
Таким образом,
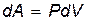 , ,
| (9.1) |
где dV=Sdx – изменение объёма газа.
Получили так называемое термодинамическое выражение для элементарной работы. Полная работа при расширении газа от объема V1 до объема V2 определяется формулой
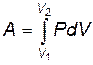 . .
| (9.2) |
Будем считать работу положительной (A>0), если система выполняет работу над внешними телами. Если же внешние тела совершают работу над системой, то она отрицательна (A<0).
7. Теплота есть количественная мера превращения энергии направленного или хаотического движения в энергию хаотического движения (рис. 9.3).
Процесс 1 происходит при торможении тел под действием силы трения. Такой процесс сопровождается превращением энергии направленного движения (кинетической энергии) тела в энергию хаотического движения частиц окружающей среды, что эквивалентно передаче ей некоторого количества теплоты. Такое же превращение энергии наблюдается в процессе, обратном показанному на рис. 9.2 (т.е. в процессе сжатия газа).
Процесс превращения энергии хаотического движения в энергию хаотического движения (канал 2 на рис. 9.3) есть не что иное, как процесс передачи теплоты от горячего тела к холодному.
 2015-02-04
2015-02-04 1745
1745








