Молекулярные структуры сопряжённых углеводородов формально можно разделить на две большие группы – альтернантные и неальтернантные углеводороды.
Для того чтобы определить к какой из двух выше перечисленных групп относится рассматриваемый углеводород, необходимо проделать формальную процедуру разметки («раскраски») атомов углерода: на одном атоме поставим метку (*), на соседнем атоме метка будет отсутствовать (0) и т.д. Такая разметка атомов углерода проводится с целью разделения последних на два сорта. Если в молекуле углеводорода каждая связь осуществляется между атомами разных сортов (между атомом с меткой и атомом без метки), то такой углеводород называется альтернантным (АУ). Если же имеется, хотя бы одна связь между атомами одного сорта (оба атома с меткой или оба атома без метки), углеводород называется неальтернантным. Разметку принято проводить таким образом, чтобы число атомов с меткой было больше, чем число атомов без метки. Легко заметить, что сопряжённая система является альтернантной в том случае, если она не содержит циклы (кольца) с нечётным числом атомов углерода. Альтернантные углеводороды (АУ) обладают определёнными свойствами, которые строго доказываются в рамках  - электронного приближения. Они известны как теоремы парности, которые приводятся здесь без доказательства.
- электронного приближения. Они известны как теоремы парности, которые приводятся здесь без доказательства.
|
|
|
Теорема 1: «Орбитали альтернантных углеводородов (АУ) разбиваются по энергии на симметричные относительно уровня 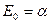 (здесь
(здесь 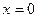 ) пары: связывающая
) пары: связывающая 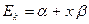 и разрыхляющая
и разрыхляющая 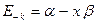 молекулярные орбитали. В системах содержащих нечётное число атомов углерода, уровень с энергией
молекулярные орбитали. В системах содержащих нечётное число атомов углерода, уровень с энергией 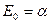 соответствует несвязывающей молекулярной орбитали, которая не имеет пары».
соответствует несвязывающей молекулярной орбитали, которая не имеет пары».
Теорема 2: «Коэффициенты при атомных орбиталях в выражениях для связывающей и симметричной ей разрыхляющей молекулярной орбитали совпадают, если атомные орбитали принадлежат атомам с меткой, и различаются знаком, если атомные орбитали принадлежат атомам без метки».
Теорема 3: «В случае несвязывающей молекулярной орбитали коэффициенты при атомных орбиталях атомов без метки равны нулю. При этом сумма коэффициентов при атомных орбиталях атомов с метками, примыкающих к данному атому без метки, равна нулю».
Теорема 4: «Электронная плотность на каждом атоме углерода в альтернантных углеводородах равна 1,000. Следовательно, альтернантный углеводород характеризуется однородным распределением заряда. В связи с этим,  - составляющая дипольного момента альтернантного углеводорода равна нулю. Этот вывод имеет экспериментальное подтверждение. У альтернантных углеводородов полностью отсутствует или имеется пренебрежимо малый полный дипольный момент». В общем случае, разделение углеводородов на альтернантные и неальтенантные относится не только к циклическим сопряжённым системам, но и к линейным полиенам
- составляющая дипольного момента альтернантного углеводорода равна нулю. Этот вывод имеет экспериментальное подтверждение. У альтернантных углеводородов полностью отсутствует или имеется пренебрежимо малый полный дипольный момент». В общем случае, разделение углеводородов на альтернантные и неальтенантные относится не только к циклическим сопряжённым системам, но и к линейным полиенам 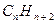 , для которых характерно чередование (альтернирование) одинарных и двойных связей. Полиены подразделяются по числу атомов углерода в цепи на чётные и нечётные. Чётные полиены – обычные молекулы, например этилен, бутадиен, гексатриен и др. Полиены с нечётным числом атомов углерода представляют собой свободные радикалы, простейшим из которых является радикал аллил. Особенностью структуры линейного полиена является цепочка связанных (сопряжённых) атомов, вдоль которой движутся электроны, образующие
, для которых характерно чередование (альтернирование) одинарных и двойных связей. Полиены подразделяются по числу атомов углерода в цепи на чётные и нечётные. Чётные полиены – обычные молекулы, например этилен, бутадиен, гексатриен и др. Полиены с нечётным числом атомов углерода представляют собой свободные радикалы, простейшим из которых является радикал аллил. Особенностью структуры линейного полиена является цепочка связанных (сопряжённых) атомов, вдоль которой движутся электроны, образующие  - электронную систему. При этом
- электронную систему. При этом  - электроны «не привязаны» к какой-либо паре углеродных атомов полиена, как это обычно бывает в случае
- электроны «не привязаны» к какой-либо паре углеродных атомов полиена, как это обычно бывает в случае 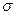 - связи, а распределены по всем атомам, которые включены в
- связи, а распределены по всем атомам, которые включены в  - электронную систему. При этом в силу соображений симметрии, возможно разделение
- электронную систему. При этом в силу соображений симметрии, возможно разделение 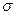 - и
- и  - электронных движений, считая приближённо, что каждое из них осуществляется независимыми друг от друга. В некоторых случаях
- электронных движений, считая приближённо, что каждое из них осуществляется независимыми друг от друга. В некоторых случаях 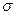 - связи также могут иметь делокализованный характер, например в диборане
- связи также могут иметь делокализованный характер, например в диборане 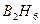 электроны делокализованы на мостиковых
электроны делокализованы на мостиковых 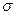 - связях. В молекулах же линейных полиенов атомы водорода не принимают участия в образовании
- связях. В молекулах же линейных полиенов атомы водорода не принимают участия в образовании  - электронной системы, поскольку связаны с атомами углерода простыми одинарными
- электронной системы, поскольку связаны с атомами углерода простыми одинарными 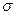 - связями. При этом
- связями. При этом  - орбитали более высокие по энергии чем
- орбитали более высокие по энергии чем 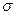 - орбитали, поэтому они в основном считаются ответственными за реакционную способность и спектры молекул. В связи с этим, в методе Хюккеля
- орбитали, поэтому они в основном считаются ответственными за реакционную способность и спектры молекул. В связи с этим, в методе Хюккеля 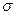 - орбитали не рассматриваются, хотя по всем данным взаимодействие
- орбитали не рассматриваются, хотя по всем данным взаимодействие 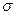 - и
- и  - орбиталей велико и существенно влияет на свойства молекул. Роль такого влияния учитывается в более точных вычислительных полуэмпирических схемах, например в методе Паризера – Пара и Попла (ППП). Действительно, расчёты по методу Хюккеля не учитывают эффекта корреляции электронов, их стремления избегать друг друга вследствии взаимного отталкивания последних. Именно поэтому
- орбиталей велико и существенно влияет на свойства молекул. Роль такого влияния учитывается в более точных вычислительных полуэмпирических схемах, например в методе Паризера – Пара и Попла (ППП). Действительно, расчёты по методу Хюккеля не учитывают эффекта корреляции электронов, их стремления избегать друг друга вследствии взаимного отталкивания последних. Именно поэтому  - электроны в таких молекулах как бутадиен, гексатриен, октатриен, декапентаен и других чётных полиенах стремятся сосредоточиться в чередующихся (альтернирующих) связях, и порядок их соответствует единственной классической структурной формуле, хотя существование общей
- электроны в таких молекулах как бутадиен, гексатриен, октатриен, декапентаен и других чётных полиенах стремятся сосредоточиться в чередующихся (альтернирующих) связях, и порядок их соответствует единственной классической структурной формуле, хотя существование общей  - электронной системы, несомненно. В то же время у нечётных полиенов, для которых, как и для аллила, можно написать более одной структурной формулы, распределение сильно отличается от классического и порядок
- электронной системы, несомненно. В то же время у нечётных полиенов, для которых, как и для аллила, можно написать более одной структурной формулы, распределение сильно отличается от классического и порядок  - связей значительно выровнен. Их описание в рамках классических структурных формул вообще невозможно.
- связей значительно выровнен. Их описание в рамках классических структурных формул вообще невозможно.
|
|
|
 2015-03-22
2015-03-22 862
862







