[убрать]
· 1 История
· 2 Принцип работы
· 3 Применение
· 4 См. также
· 5 Примечания
· 6 Ссылки
История[править | править вики-текст]
Тёмные линии на спектральных полосках были замечены давно, но первое серьёзное исследование этих линий было предпринято только в 1814 году Йозефом Фраунгофером. В его честь эффект получил название «Фраунгоферовы линии». Фраунгофер установил стабильность положения линий, составил их таблицу (всего он насчитал 574 линии), присвоил каждой буквенно-цифровой код. Не менее важным стало его заключение, что линии не связаны ни с оптическим материалом, ни с земной атмосферой, но являются природной характеристикой солнечного света. Аналогичные линии он обнаружил у искусственных источников света, а также в спектрах Венеры и Сириуса.
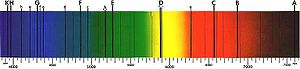
Пример линейного спектра поглощения
Вскоре выяснялось, что одна из самых отчётливых линий всегда появляется в присутствии натрия. В 1859 году Г. Кирхгоф и Р. Бунзен после серии экспериментов заключили: каждый химический элемент имеет свой неповторимый линейчатый спектр, и по спектру небесных светил можно сделать выводы о составе их вещества. С этого момента в науке появился спектральный анализ, мощный метод дистанционного определения химического состава.
Для проверки метода в 1868 году Парижская академия наук организовала экспедицию в Индию, где предстояло полное солнечное затмение. Там учёные обнаружили: все тёмные линии в момент затмения, когда спектр излучения сменил спектр поглощения солнечной короны, стали, как и было предсказано, яркими на тёмном фоне.
Природа каждой из линий, их связь с химическими элементами выяснялись постепенно. В 1860 году Кирхгоф и Бунзен при помощи спектрального анализа открыли цезий, а в 1861 году — рубидий. А гелий был открыт на Солнце на 27 лет ранее, чем на Земле (1868 и 1895 годы соответственно).
В 1933 году в Ленинградском институте исторической технологии впервые применили спектральный анализ древних металлических изделий[1].
Принцип работы[править | править вики-текст]
Атомы каждого химического элемента имеют строго определённые резонансные частоты, в результате чего именно на этих частотах они излучают или поглощают свет. Это приводит к тому, что в спектроскопе на спектрах видны линии (тёмные или светлые) в определённых местах, характерных для каждого вещества. Интенсивность линий зависит от количества вещества и его состояния. В количественном спектральном анализе определяют содержание исследуемого вещества по относительной или абсолютной интенсивностям линий или полос в спектрах.
Оптический спектральный анализ характеризуется относительной простотой выполнения, отсутствием сложной подготовки проб к анализу, незначительным количеством вещества (10—30 мг), необходимого для анализа на большое число элементов.
Атомарные спектры (поглощения или испускания) получают переведением вещества в парообразное состояние путём нагревания пробы до 1000—10000 °C. В качестве источников возбуждения атомов при эмиссионном анализе токопроводящих материалов применяют искру, дугу переменного тока; при этом пробу помещают в кратер одного из угольных электродов. Для анализа растворов широко используют пламя или плазму различных газов.
Применение[править | править вики-текст]
В последнее время, наибольшее распространение получили эмиссионные и масс-спектрометрические методы спектрального анализа, основанные на возбуждении атомов и их ионизации в аргоновой плазме индукционных разрядов, а также в лазерной искре.
Спектральный анализ — чувствительный метод и широко применяется в аналитической химии, астрофизике, металлургии, машиностроении, геологической разведке, археологии и других отраслях науки.
В теории обработки сигналов, спектральный анализ также означает анализ распределения энергии сигнала (например, звукового) по частотам, волновым числам и т. п.
См. также[править | править вики-текст]
Колоночная хроматография – способ препаративного разделения смесей жидких или твердых веществ, основанный на различном сродстве разделяемых веществ к неподвижной (сорбент) и подвижной (элюент) фазам. Как правило, чем лучше вещество сорбируется неподвижной фазой - тем медленнее вещество выходит с колонки.
 2015-03-22
2015-03-22 471
471







