Условие: Определить объем и состав в объемных % продуктов горения, образовавшихся при сгорании 1 кг бензола С6Н6. Начальная температура окружающей среды 200С, давление 770 мм рт.ст., коэффициент избытка воздуха a = 1.4, температура горения 1500°С.
1. Записываем уравнение реакции горения
С6Н6 + 7,5(О2 + 3,76N2) = 6СО2 + 3Н2О + 7,5×3,76N2
2. По уравнению реакции горения определяем количество каждого из продуктов сгорания:
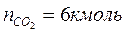
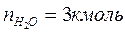
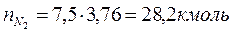
Поскольку в рассматриваемом случае горение протекает с избытоком воздуха (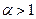 ), необходимо учесть остаточный кислород в продуктах сгорания и азот в избытке воздуха:
), необходимо учесть остаточный кислород в продуктах сгорания и азот в избытке воздуха:
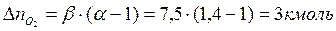
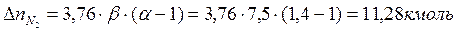
Таким образом, практический состав продуктов сгорания следующий:
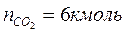
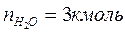
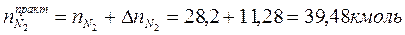
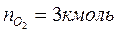
3. Определяем общее количество продуктов сгорания при сжигании 1 киломоля горючего:
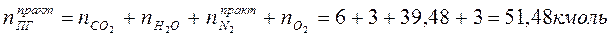
4. Определяем процентный состав продуктов горения:

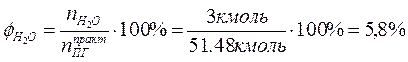
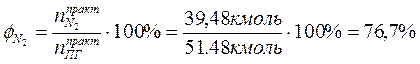
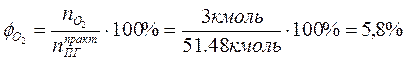
Производим проверку: 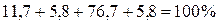
Поскольку известно, что 1 киломоль любого газа или пара при одинаковых условиях занимает одинаковый объем, то найденные концентрации также будут являться и объемными концентрациями продуктов сгорания.
|
|
|
5. Определяем общее количество продуктов сгорания при сжигании 1 кг горючего, для этого составляем пропорцию:

Отсюда: 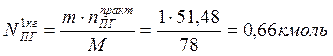
6. При определения общего объема продуктов сгорания, примем, что нагретые до высокой температуры продукты сгорания отдают свою теплоту в окружающее пространство и строительным конструкциям, поэтому температуру продуктов сгорания принимаем 20°С (см. условие задачи).
Рассчитаем, какой объем занимает 1 кмоль газообразных веществ при заданных температуре и давлении.
 м3/кмоль
м3/кмоль
 Объем продуктов сгорания составит:
Объем продуктов сгорания составит:
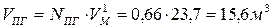
ОТВЕТ:
При сжигании 1 кг бензола при заданных условиях выделяется 15,6 м3 продуктов сгорания, из них: СО2 – 11,7%; Н2О – 5,8%; N2 – 76,7%; О2 – 5,8%.
 2015-03-27
2015-03-27 3579
3579
