Среди пострадавших с повреждениями органов брюшной полости травма тонкой кишки встречалась наиболее часто — у 808 человек: ранение получил 521 (ножевое — 492, огнестрельное — 29) человек, разрыв — 287. Если раненые оперированы преимущественно (82,3%) в первые 6 ч с момента травмы, то большинство (68,6%) пострадавших с разрывом кишки — в более поздние сроки, что обусловлено поздним обращением за медицинской помощью.
Основной объем вмешательства при повреждениях тонкой кишки — ушивание раны (разрыва), хотя и существует мнение, что при разрыве кишки резекция надежнее (В. П. Тявкин и соавт., 1990). Резекция сегмента тонкой кишки произведена нами 20 (4,1%) пострадавшим с ранениями и 70 (24,3%) — с разрывом органа по следующим показаниям: отрыв брыжейки от кишки (56), размозжение сегмента кишки (17), повреждение сосуда брыжейки с расстройством регионарного кровообращения (8), наличие множественных ран на небольшом участке (6), некроз ущемленной в ране брюшной стенки петли (3). 4 пострадавшим резекция терминаль-
ного отдела подвздошной кишки из-за тяжести перитонита завершена формированием концевой илеостомы; непрерывность кишки восстанавливалась после стихания перитонита, при удовлетворительном состоянии больного — обычно через 1—1,5 мес после первичного вмешательства.
Осложнения в послеоперационном периоде возникли у 9,3% пострадавших с ножевыми ранениями, у 31 % — с огнестрельными и у 30,4% — с разрывом кишки. Превалировали (90%) гнойные осложнения. При этом следует учесть, что большинство пострадавших с разрывом тонкой кишки из-за поздней госпитализации уже оперированы с клиникой общего перитонита. Не вдаваясь в детали патогенеза и лечения перитонита, считаем уместным подчеркнуть, что и на сегодняшний день остаются актуальными взгляды С. С. Юдина (1960) на эту чрезвычайно сложную проблему. Так, С. С. Юдин утверждал, что при перитоните образуется «заколдованный круг», а именно: воспаление брюшины вызывает паралич кишечной перистальтики, следствием которого является стаз кишечного содержимого, прогрессирование интоксикации, что, в свою очередь, усугубляет динамическую непроходимость. С. С. Юдин особо подчеркивал, что в разгар перитонита, когда кишечник резко раздут газами и переполнен жидким содержимым, невозможно хоть сколько-нибудь улучшить перистальтику с помощью лекарственных средств. Между тем раннее восстановление перистальтики кишечника необходимо рассматривать как одну из основных задач в программе лечебных мероприятий при перитоните. Для разрешения динамической непроходимости С. С. Юдиным была предложена подвесная энтеросто-мия. С этой же целью используются трансцекальная интубация тонкой кишки или через гастростому — по методике Ю. М. Дедерера. Однако при перитоните, когда репаративные возможности организма резко снижены, реальна опасность отхождения подшитых к париетальной брюшине полых органов, что усугубляет и без того крайне тяжелое состояние больных. Трансцекальная интубация тонкой кишки сложна еще и технически, часто сопровождается дополнительным инфицированием брюшной полости. Наблюдали мы и кровотечение из стенки желудка при трансгастральной интубации тонкой кишки. Поэтому уже около 30 лет применяем трансназальный путь введения зонда в тонкую кишку Полихлорвиниловый или силиконовый зонд проводится на 30—60 см дистальнее связки Трейтца, а при тяжелой паралитической непроходимости интубируем всю тонкую кишку. Обычно эта манипуляция при наличии соответствующих навыков занимает не более 15 мин. Кишка одномоментно освобождается от токсического содержимого и промывается. Декомпрессия кишки способствует улучшению микроциркуляции в ее стенке, мышцы быстрее «набирают силу», что благоприятствует восстановлению перистальтики; кроме того, возможно раннее применение энтерального питания через зонд (на 3—4-е сутки), что становится естественным стимулятором перистальтики. Известно, что раннее восстановление перистальтики в послеоперационном периоде явля-
ется самой действенной мерой профилактики спаечной болезни (Н. С. Тимофеев, Р. И. Житнюк, 1970), а также несостоятельности ушитых ран и сформированных межкишечных анастомозов.
Несостоятельность швов после ушивания ножевых ран тонкой кишки развилась у 0,7%, огнестрельных — у 9,5%, разрывов — у 4,1% пострадавших. Несостоятельность межкишечных анастомозов, наложенных по типу «конец в конец», выявлена у 9,4%, а «бок в бок» — у 12,5% оперированных. На развитие этих осложнений помимо механизма травмы, техники оперативного вмешательства оказывала влияние и адекватность декомпрессии кишки; у некоторых больных не удавалось провести зонд за связку Трейтца или он перегибался и не функционировал. При релапаротомии, предпринятой в связи с несостоятельностью швов межкишечного соустья, ушиванию дефекта в анастомозе предпочитали его резекцию. После резекции анастомоза в терминальном отделе подвздошной кишки накладывали илеоасцен-до- или илеотрансверзоанастомоз, а в условиях калового перитонита ограничивались концевой илеостомой. В послеоперационном периоде помимо индивидуально составленной программы инфузионной и антибактериальной терапии применяли экстракорпоральные методы детоксикации: гемосорбцию, спленосорбцию, плазмаферез; забор крови непосредственно из портального кровотока через катетеризированную пупочную вену повышал их детоксикационный эффект.
Летальность при ножевых ранениях тонкой кишки составила 4,5%; при огнестрельных — 10,3%, при разрывах — 17,9%. При ранениях основной причиной смерти было массивное кровотечение из поврежденных крупных сосудов брюшной полости, при разрывах — перитонит Влияние фактора времени на исход лечения отчетливо прослеживается у пострадавших с разрывом тонкой кишки: при оперативном вмешательстве, выполненном до суток с момента травмы, летальность составила 10,5%, а в более поздние сроки — 44,7%. Что касается пострадавших с огнестрельным ранением тонкой кишки, то большинство из них (82,3%) оперированы не позже 6 ч с момента ранения, да и шанс выздоровления для данного контингента больных реален лишь при раннем оперативном вмешательстве, так как часто бывают повреждены крупные сосуды брюшной полости.
Повреждение всех слоев стенки ободочной кишки имело место у 222 человек: ранение — у 206 (ножевое — у 176, огнестрельное — у 30), разрыв — у 16. Сроки оперативного вмешательства в этой группе больных были те же, что и у пострадавших с повреждениями тонкой кишки, а именно: в первые 6 ч с момента травмы оперированы 83,5% больных с ранениями и только 1 из 16 — с разрывом ободочной кишки. Основанием для экстренного вмешательства также являлась клиника перитонита, но в сравнении с повреждениями тонкой кишки она была менее выраженной. Аналогичные данные приведены в литературе (Н. С. Утешев и соавт, 1983; К. Н. Тарун, 1985). Однако если многие хирурги улучшение исходов у пострадавших с травмой ободочной кишки связывают прежде всего с уменьшением количества первичных восстановительных операций — в 60—74%
вмешательство завершается колостомией (В. Д. Федоров и соавт., 1988; С. Orsay et al., 1989, и др.), то мы первичное восстановление пассажа кишечного содержимого предприняли 82,9% больным: при ножевых ранениях — 89,2%, при огнестрельных — 70%, при разрывах — 6 из 16. Чаще всего (96,7%) целостность кишки восстанавливали ушиванием раны (разрыва). Такой объем вмешательства считается допустимым только в ранние сроки; Г. Н. Цыбуляк (1995) и Н. А. Ефименко (2003) ограничивают это время 2 часами. Мы ушили ножевые раны кишки в течение 6 ч с момента ранения 113 пострадавшим, позже 6 ч — 43. Несомненно, мы разделяем мнение авторов, допускающих, что первичное восстановление пассажа по ободочной кишке возможно лишь при «опрятных» ранах (L. Goldman et al., 1962). Если брюшная полость была загрязнена калом, то ушивание раны кишки и, тем более, создание межкишечного анастомоза считали неоправданным риском.
Применяемая нами хирургическая тактика отличается от рекомендуемой Е. М. Благитко (1990), который при повреждениях слепой кишки, независимо от механизма травмы, наличия перитонита, ограничивает объем вмешательства ушиванием раны с последующей цекопексией к краям раны брюшной стенки, а при травме восходящей кишки и отсутствии перитонита — правосторонней гемиколэктомией, опять же без учета тяжести повреждения органа. При повреждении поперечно-ободочной или нисходящей кишки автор выполняет такой объем вмешательства: «поврежденный сегмент кишки выводят наружу или иссекают, а на проксимальный отрезок кишки накладывают одноствольный или двуствольный задний проход в зависимости от длины удаленной кишки».
При повреждении слепой кишки и своевременном оперативном вмешательстве мы считаем допустимым ушивание раны кишки. Однако если у хирурга возникают сомнения относительно опасности развития несостоятельности швов, особенно при огнестрельном характере ранения, то стенка слепой кишки в окружности ушитой раны подшивается к краям брюшины отдельного разреза брюшной стенки в подвздошной области; в условиях перитонита формируется цеко-стома на месте имеющейся раны.
При ножевом ранении восходящего отдела ободочной кишки и отсутствии перитонита ограничиваемся ушиванием раны. Если ранение огнестрельное, когда велика опасность несостоятельности швов, тем более если оно сквозное, или ножевое, но вмешательство выполняется в условиях перитонита или забрюшинной флегмоны, то после ушивания раны необходимо выключить поврежденный сегмент кишки из пассажа. Рекомендуемая с этой целью цекостома (Н. А. Ефименко, 2003) не обеспечивает полного выключения пассажа кишечного содержимого. Мы с этой целью применяем петлевую илеостому, которую накладываем в 40—50 см от слепой кишки. При множественных повреждениях восходящей кишки, когда органосохраняющее вмешательство оказывается невозможным, выполняем правостороннюю гемиколэктомию с наложением илеотранс-
верзоанастомоза. Однако при распространенном каловом перитоните или даже в случае своевременной операции, если состояние пострадавшего крайне тяжелое из-за сопутствующих повреждений жизненно важных органов груди, обескровливания, после гемиколэктомии ограничиваемся концевой илеостомией; более того, при запущенном каловом перитоните периферический конец поперечной ободочной кишки также выводится наружу. Наличие перитонита при повреждениях восходящей кишки не является определяющим фактором, на основании которого мы решаем вопрос о целесообразности гемиколэктомии; от тяжести перитонита зависит только, как завершится гемиколэктомия — восстановлением пассажа по кишечнику или формированием концевой илеостомы.
При ранении (разрыве) поперечной ободочной кишки, ее печеночного и селезеночного изгибов, адекватным объемом вмешательства в течение 6 ч с момента травмы является ушивание раны кишки двухрядным швом. В условиях перитонита, загрязнения брюшной полости формируется колостома на месте повреждения кишки. Размозжение сегмента кишки, отрыв брыжейки служит показанием к резекции этого участка, после чего допускается восстановление целостности кишки межкишечным соустьем, но чаще из-за переполнения кишки калом, загрязнения брюшной полости, тяжелого состояния пострадавшего и, тем более, наличия перитонита приходится ограничиться выведением проксимального конца кишки по типу концевой трансверзостомы.
При ранениях и закрытой травме левой половины толстой кишки, включая внутрибрюшинный отдел прямой кишки, Н. А. Ефименко (2003) рекомендует резецировать поврежденный сегмент кишки; приводящий отдел использовать для формирования одноствольной колостомы, а отводящий заглушить и погрузить в брюшную полость. Подобную тактику автор обосновывает высоким риском несостоятельности швов при первичном ушивании дефектов и значительными трудностями экстраперитонизации левой половины толстой кишки. С нашей точки зрения, такой радикализм нецелесообразен. При ранении нисходящего отдела кишки рана ушивается. Профилактика несостоятельности швов в случае позднего вмешательства достигается выключением пассажа по кишке с помощью петлевой трансверзостомы. И только если органосохраняющее вмешательство невозможно из-за тяжести повреждения данного сегмента кишки, то предпринимается левосторонняя гемиколэктомия с формированием концевой трансверзостомы.
При ранении сигмовидной кишки, в зависимости от конкретной ситуации, применяется ушивание раны, то же в сочетании с экстраперитонизацией, создание колостомы на месте раны. После ушивания раны дистального отдела сигмовидной кишки для профилактики несостоятельности швов, если такая необходимость возникает, накладывается петлевая сигмостома проксимальнее. Размозжение сегмента сигмовидной кишки или повреждение брыжейки с нарушением кровоснабжения кишки служит показанием к резекционно-
му способу; меньшим риском для жизни больного является операция типа Гартмана.
Если при повреждениях ободочной кишки восстанавливался пассаж кишечного содержимого, то считали целесообразным завершить оперативное вмешательство растяжением сфинктера (дивульсией) по методу А. Н. Рыжиха (1960).
Послеоперационный период протекал с осложнениями у 30,1% пострадавших с ножевыми ранениями, у 46,7% — с огнестрельными и у 8 из 16 — с разрывом ободочной кишки. Несостоятельность швов после ушивания ножевых ранений кишки в первые 6 ч с момента травмы развилась в 3,5% наблюдений, а в более поздние сроки—в 7,0%. Ушивание огнестрельных ран ободочной кишки осложнилось несостоятельностью швов у 5 из 16 больных, что подтверждает предположение авторов, связывающих частоту этого грозного осложнения с наличием зоны ушиба в окружности раны, в которой происходят морфологическая перестройка поврежденной стенки и микроциркуляторные нарушения (Б. Н. Федоров и соавт., 1989; П. Н. Зубарев, 2001). Правомерность такого утверждения подтверждает тот факт, что после резекции сегмента ободочной кишки, выполненной 5 раненым, несостоятельности швов межкишечного соустья не возникло. После ушивания разрыва ободочной кишки несостоятельность швов развилась у 1 из 6 пострадавших.
Погибли 8 (4,5%) пострадавших с ножевыми (6 — от массивной кровопотери, 2 — от перитонита), 8 (26,7%) — с огнестрельными ранениями (4 получили травму жизненно важных органов груди, 4 — множественные повреждения органов живота), 6 из 16 больных — с разрывом ободочной кишки (основной причиной смерти был прогрессирующий перитонит).
Мы располагаем небольшим количеством наблюдений травм прямой кишки (27) самой разнообразной этиологии. Внутрибрюшинный отдел кишки оказался поврежденным у 5 человек, внебрюшинный — у 20, оба — у 2. У большинства больных восстановление целостности кишки сочетали с выключением пассажа по поврежденному участку путем создания петлевой сигмостомы; такой объем вмешательства произведен 13 пострадавшим. Рана кишки без наложения сигмостомы ушита еще 4 больным: 2-е повреждением внутрибрюшинного и 2 — с повреждением внебрюшинного отдела прямой кишки. При лечении 10 пострадавших с травмой внебрюшинной части прямой кишки, госпитализированных в поздние сроки, ограничились только формированием петлевой сигмостомы, а реконструктивное вмешательство осуществляли после стихания воспалительного процесса в окружающих рану тканях и улучшения состояния пострадавшего. Необходимо преодолеть психологический барьер перед формированием калового свища, который существует не только у больного, но и у хирурга. Мысль, что выключение поврежденного участка кишки улучшит условия для регенерации, а возможно, и предупредит жизнеугрожающие осложнения, должна отмести все сомнения в пользу временной колостомы.
Таким образом, объем оперативного вмешательства при травме различных отделов толстой кишки зависит от тяжести и характера их повреждения, сроков вмешательства, степени загрязнения брюшной полости, общего состояния пострадавшего, которое обусловлено тяжестью и распространенностью перитонита, кровопотерей, наличием сочетанных повреждений.
СПИСОК ЛИТЕРАТУРЫ
Алиев С. А. Повреждения толстой кишки в неотложной хирургии // Хирургия.— 2000.- № 10.- С. 35-40.
Гусейнов Б. Н., Юсибов Д. К., Велиев Э. А., Садыхов И. К. Непосредственные результаты лечения при огнестрельных ранениях толстой кишки // Вестн. хирургии.— 2000.- № 6.- С. 43-45.
Корабельников А. И. Проникающие ранения живота мирного времени с повреждениями тонкой кишки // Хирургия.— 1990.— № 9.— С. 50—52.
Куликов Л. К., Зайчук И. П., Манн В Л., Привалов Ю. А. Диагностические и тактические ошибки в хирургии повреждений прямой кишки // Вестн. хирургии.— 1993.— № 5-6.- С. 97-101.
Ревской А. К., Войновский Е. А., Клипак В. М. Огнестрельные ранения прямой кишки // Хирургия.— 1997.— № 9.— С. 4—7.
Шорох Г. П., Тарун К. Н. Лечебная тактика при травмах ободочной кишки // Хи-рургия.- 1987.- № 3.- С. 17-27.
Cook А., Levine В., Rusing Т. et al. // Traditional treatment of colon injuries. An effective method // Arch Surg- 1984.- Vol. 119.- № 5.- P. 591-594.
George S., Fabian Т., Mangiante E. Colon trauma: further support for primary repair // Curr. Surg.- 1990.- Vol. 47.- № 1.— P. 68-69.
Orsay C, Merlotti G., Abcarian H. et al. Colorecte Trauma // Dis. Colon Rectum.— 1989.- Vol. 32.- № 3.- P 188-190.
Robbs S., Moore S., Pillay S. Blunt abdominal trauma with jejunal injury: a review // S. Trauma.- 1980.- Vol. 20.- № 4.- P. 308-311.
Tuggle D., Huber P. Management of rectal trauma // Amer. J. Surg.— 1984.— Vol. 148.— № 6.- P. 806-808.
ГЛАВА 9
СОЧЕТАННАЯ ЗАКРЫТАЯ ТРАВМА ЖИВОТА
Отличительной особенностью травм в индустриально развитых странах является их сочетанный характер. Среди причин смертности населения в возрасте до 40 лет сочетанные повреждения занимают первое место (А. С. Ермолов, 2003). Повреждения живота у пострадавших с сочетанной травмой встречаются в 18,2—53% случаев (В. Т. Зайцев и соавт., 1983; А. Е. Романенко, 1985; П. Г. Брюсов и соавт., 2001; J. Gastinger et al., 1990). Даже в мирное время, когда возможно применение современных методов диагностики и адекватной комплексной терапии, летальность при сочетанной закрытой травме живота остается высокой — 25—69,7% (В. Е. Закурдаев, 1976; Н. К. Голобородько, В. В. Булага, 1986; Г. Н. Цыбуляк, 1995; А. Б. Сингалевский, И. Ю. Малых, 2001; С. Herve et al., 1987). При этом некоторые авторы (М. В. Шеляховский, В. И. Пашкевич, 1982) сообщают только о послеоперационной летальности, не учитывая пострадавших, которым оперативное пособие не оказывалось из-за крайней тяжести их состояния или вследствие того, что повреждения органов брюшной полости были распознаны только на аутопсии. Не учитывают также погибших на месте происшествия и во время транспортировки. Между тем, по данным Б. Э. Альтшулера (1975), среди умерших от торакоабдоминальной травмы моментальная смерть наступила у 58,7% пострадавших.
Летальность при сочетанной травме не имеет тенденции к снижению, что является следствием всевозрастающей тяжести повреждений, полученных большинством пострадавших при автодорожных происшествиях и падении с высоты (П. В. Ильин, 1986; Г. И. Назаренко и соавт., 1990). Наиболее частой причиной смерти являются травматический шок в сочетании с кровопотерей (32,5—52,5%) и черепно-мозговая травма (30,6—40,7%) (В. В. Кузьменко и соавт., 1986; М. В. Гринев, Б. Н. Саламатин, 1986; G. Webb et al., 1990). Среди погибших от сочетанной травмы живота и головы несовместимые с жизнью повреждения явились причиной смерти в 41% наблюдений (С. 3. Горшков и соавт., 1986). Неуклонно возрастающей
частотой сочетанных травм, высокой летальностью и инвалидизацией пострадавших, большинство которых трудоспособного возраста, объясняется тот неопровержимый факт, что данная проблема стала не только медицинской, но и социально значимой. Следует также учесть, что в случае разнообразных природных катастроф и тем более в условиях применения оружия массового уничтожения большинство пострадавших будет иметь сочетанные и комбинированные травмы. При этом повреждения органов живота у значительного числа пострадавших окажутся множественными, поступление их в лечебные учреждения — массовым, а силы и средства медицинской службы — ограниченными.
Одними из резервов улучшения результатов лечения пострадавших с сочетанной травмой являются раннее выявление ведущего, определяющего тяжесть состояния больного повреждения, своевременное проведение лечебных мероприятий, корригирующих уже развившиеся в остром периоде травматической болезни жизнеугрожающие осложнения.
Распознавание внутрибрюшной катастрофы у пострадавших с сочетанной травмой представляет особую сложность. Наличие травмы других анатомических областей может затушевывать симптомы повреждений органов брюшной полости, и тогда лапаротомия выполняется уже на фоне тяжелого кровотечения или общего перитонита; в то же время травма груди, позвоночника, таза способна дать ложную клинику «острого живота», в связи с чем, вследствие гипердиагностики, предпринимается напрасное оперативное вмешательство. Так, напряжение мышц передней брюшной стенки и симптом Блюмберга — Щеткина выявляется только у 30—35% больных с повреждением полого органа; с такой же частотой обнаруживается притупление в отлогих местах живота в случае кровотечения в свободную брюшную полость. Перечисленные симптомы имеют место у 25—30% пострадавших, целостность органов брюшной полости которых оказалась сохранной (А. Н. Беркутов и соавт., 1976; М. Г. Урман и соавт., 1999). На фоне шока повреждения опорно-двигательного аппарата и головы дают более яркую клиническую картину в сравнении с травмой живота, «классические» симптомы которой сглаживаются (Г. Г. Лупанов, М. И. Боровской, 1982). При тяжелом ушибе головного мозга проявления черепно-мозговой травмы продолжительны, могут развиться глубокие нарушения рефлекторных связей и сознания, вследствие чего абдоминальная симптоматика не проявляется; в свою очередь, оценка истинной тяжести травмы головного мозга становится возможной только после устранения патологического влияния абдоминальных повреждений, прежде всего после восполнения объема циркулирующей крови (П. В. Ильин, 1986). Диагностика еще более сложна у пострадавших, находящихся в состоянии алкогольного опьянения.
Из-за тяжести состояния пострадавших врач ограничен во времени для проведения углубленного обследования и тем более динамического наблюдения. Дефицит во времени и экстремальность об-
становки особенно ощутимы при массовом поступлении пострадавших. Поэтому абсолютно правы клиницисты, считающие, что в случае нарушения жизненных функций организма у пострадавшего хирург не должен стремиться к топическому диагнозу, во всяком случае это не должно быть самоцелью (В. Е. Закурдаев, 1976; Н. Polk, L. Flint, 1983). И все же, если при изолированной закрытой травме живота хирург вправе ограничить задачу диагностических поисков установлением факта внутрибрюшной катастрофы, то при сочетанной травме необходимо еще выяснить, чем конкретно обусловлена эта катастрофа. Обязательно выявление ведущего повреждения, которое в данный момент представляет реальную угрозу для жизни (Ю. Г. Шапошников и соавт., 1990).
При сочетанной травме основополагающим методом диагностики остается клинический, основанный на изучении жалоб пострадавшего, обстоятельств происшествия, уточнении динамики в состоянии больного и эффективности проводимой на догоспитальном этапе терапии, данных осмотра, физикального исследования: пальпации, перкуссии, аускультации (Г. Н. Цыбуляк, С. Д. Шеянов, 2001; D. Wilker, 1982).
Особые сложности в распознавании внутрибрюшной катастрофы возникают у пострадавших с тяжелой черепно-мозговой травмой, поступивших с расстройством сознания. Бледность кожи и слизистых, тахикардия, низкое артериальное давление, как и кратковременное его повышение в ответ на инфузионную терапию, равномерно расширенные зрачки скорее всего свидетельствуют об острой кровопотере. Вероятность наличия повреждений органов брюшной полости возрастает, если мышцы передней брюшной стенки напряжены при отсутствии гипертонуса мышц конечностей, тимпанит над областью печени, притупление в отлогих местах живота, болевая реакция на пальпацию, проявляющаяся стоном или попыткой больного отстранить руку врача (И. 3. Козлов и соавт., 1988).
При переломах ребер природу напряжения мышц передней брюшной стенки уточняют повторным осмотром после анестезии мест переломов ребер и паравертебральной блокады 0,25% раствором новокаина. Блокада обычно устраняет напряжение, если оно обусловлено раздражением межреберных нервов. Аналогичный эффект при переломе костей таза может оказать блокада по Школьникову — Селиванову, если напряжение мышц передней брюшной стенки является следствием забрюшинной гематомы. Целесообразно также проверить наличие симптома Джойса: при кровотечении в забрюшинное пространство притупление над отлогими местами живота, в отличие от кровотечения в свободную брюшную полость, не исчезает при повороте больного на здоровый бок. Учитывая, что у каждого второго пострадавшего с тяжелой травмой таза возникает разрыв мочевого пузыря, необходимо убедиться в его целостности.
Анализ обстоятельств травмы позволяет предположить возможные повреждения. Так, локальный удар в эпигастральную область нередко влечет за собой разрыв поджелудочной железы или двенад-
цатиперстной кишки. Резкое сдавление груди и живота может вызвать разрыв диафрагмы. Повреждения органов брюшной полости реальны у пострадавшего с черепно-мозговой травмой, доставленного в бессознательном состоянии, если травма получена при автодорожном происшествии или падении с высоты.
Жалобы разнообразны, и необходима интерпретация каждой из них с учетом уже выявленных повреждений других анатомических областей.
Боль — наиболее частый симптом, свидетельствующий о наличии внутрибрюшной катастрофы. Локализация болей, особенно в первые часы после травмы, обычно соответствует проекции поврежденного органа. Боль в «глубине» эпигастральной области характерна для травмы поджелудочной железы, может наблюдаться и при повреждении двенадцатиперстной кишки, в мезогастрии — при разрыве брыжейки тонкой кишки, в правом подреберье — печени, в левом — селезенки. Локальная боль иногда наблюдается и при повреждении кишки, а по мере развития перитонита боль становится распространенной. При повреждении паренхиматозных органов довольно часто отмечается иррадиация болей за пределы брюшной полости. Так, симптом Кера — боль в животе, иррадиирующая в плечо или лопатку,— наблюдается при разрыве селезенки и печени; происхождение симптома обусловлено раздражением кровью диафрагмального нерва Опоясывающий характер болей в верхней половине живота уже свидетельствует о развитии посттравматического панкреатита. В то же время интенсивная боль в животе может наблюдаться только при травме брюшной стенки, а также у пострадавших с забрюшинной гематомой, травмой груди, позвоночника. Отсутствие болевого синдрома у пострадавшего, находящегося в состоянии шока или алкогольного опьянения, еще не позволяет исключить внутрибрюшную катастрофу.
Рвота вскоре после травмы может возникать при повреждении как полых, так и паренхиматозных органов. Считается, что она является следствием рефлекторной реакции рвотного центра в ответ на чрезмерное раздражение рецепторного поля брюшины (А. Г. Пугачев, Е. И Финкельсон, 1981) Рвота становится частой и обильной в токсическую фазу перитонита; частое срыгивание отмечается в полиорганную фразу перитонита, причем содержимое желудка приобретает резко неприятный, порой зловонный запах. Рвота — патогномоничный симптом травмы головного мозга; в этой ситуации она обычно обильная и ей не предшествует тошнота. Рвота кровью, при исключении источника кровотечения в носоглотке или полости рта, обычно свидетельствует о повреждении желудка.
Осмотр пострадавшего уже позволяет предположить возможный характер повреждений. Принимаются во внимание внешний вид больного, положение, которое он старается сохранить, чтобы не усилились болевые ощущения, а именно: при разрыве печени — положение на правом боку, селезенки — на левом или полусидячее. Несомненно, обращается также внимание на цвет кожных покровов, локализацию,
размеры и рисунок ссадин, гематом, форму, объем груди и живота, их участие в дыхании, на наличие деформаций конечностей, на то, сохранены ли активные движения. Ссадины и кровоподтеки на коже проекционно расположению печени, селезенки или почки являются основанием для проведения соответствующих исследований, позволяющих подтвердить или исключить их повреждения.
Бледность кожных покровов имеет диагностическую ценность преимущественно при изолированной травме живота, тогда как при сочетанной травме этот признак встречается практически с равной частотой среди пострадавших с внутрибрюшным кровотечением и имеющих только экстраабдоминальные повреждения (В. Н. Климов, Б. М. Браташ, 1983). Поэтому при оценке диагностической значимости данного признака следует учитывать характер и тяжесть повреждения других анатомических областей, травма которых может сопровождаться значительной кровопотерей: таза, груди, конечностей.
Обследование следует начинать с общедоступных физикальных методов, информативность которых зависит от опыта врача, выполняющего исследование.
Пальпация живота должна проводиться без малейших отступлений от принятой методики. Начинать следует с поверхностной пальпации. При этом, как уже указывалось, следует учитывать, что у пострадавших с тяжелой сочетанной травмой при наличии внутрибрюшной катастрофы напряжения мышц брюшной стенки может не быть и оно может быть только при экстраабдоминальных повреждениях, что снижает достоверность этого признака. Глубокая пальпация позволяет судить о размерах, консистенции органов, в частности поджелудочной железы, наличии гематомы, инфильтрата. Пальпация позволяет определить границы болезненности передней брюшной стенки, которая нередко соответствует поврежденному органу. Пальпация живота предусматривает и выявление симптома Блюмберга — Щеткина, который, однако, не отличается большой достоверностью. По данным В. Е. Закурдаева (1976), у 66,7% пострадавших с сочетанной закрытой травмой с повреждениями органов брюшной полости этот симптом был отрицательным, и в то же время он констатирован у 29% больных с травмой других анатомических областей. Поэтому состояние париетального листка брюшины необходимо еще уточнить пальцевым исследованием через прямую кишку. Это исследование особенно важно в отношении пострадавших с травмой таза; обнаружение крови в просвете кишки свидетельствует о ее повреждении.
Перкуссия живота также важна при обследовании пострадавшего с сочетанной травмой. «Укорочение» печеночной тупости характерно для повреждения желудка или кишечника. При разрыве ободочной кишки этот признак встречается чаще, чем при разрыве тонкой кишки, что связано с большим содержанием газа в толстой кишке. Однако значимость этого признака не следует абсолютизировать; отсутствие его еще не тождественно целостности желудочно-кишечного тракта, равно как и обнаружение может быть обусловлено только
выраженным парезом ободочной кишки. Перкуссия позволяет также обнаружить свободную жидкость в брюшной полости, что проявляется притуплением перкуторного звука в отлогих местах живота. Считается, что судить по данным перкуссии о наличии в брюшной полости крови или другой жидкости представляется возможным, если ее количество превышает 1 л. Вероятность обнаружения жидкости возрастает в положении больного на левом боку, чему способствует смещаемость сигмовидной кишки. И все же ложноотрицательные результаты исследования достигают 40%; несколько реже встречаются ложноположительные результаты. Если определяемая перку-торно тупость в боковом отделе живота не исчезает при повороте больного на здоровый бок, то это свидетельствует о кровотечении не в свободную брюшную полость, а в забрюшинное пространство — симптом Джойса. Данный симптом, как уже указывалось, часто встречается у пострадавших с переломами костей таза. Если перкуссия сопровождается выраженной болезненностью при слегка резистентной или даже мягкой брюшной стенке, то можно с большей долей достоверности предположить наличие внутрибрюшного кровотечения — симптом Куленкампфа.
Аускультация живота необходима для уточнения состояния моторной функции кишечника. Угнетение перистальтики в первые часы после травмы наблюдается при травматическом шоке; выраженный парез кишечника может быть обусловлен большой забрюшинной гематомой. В то же время угнетение и тем более отсутствие перистальтических шумов — один из важных симптомов перитонита.
Общий клинический анализ крови, сделанный в ранние сроки после травмы, мало помогает в диагностике. Даже при тяжелой кровопотере в первые часы количество эритроцитов и содержание гемоглобина еще остаются в пределах нормы, а следовательно, гематокрит не претерпевает изменений, чему способствуют расстройства микроциркуляции, нарушающие транскапиллярную миграцию жидкости, т. е. мы исследуем кровь, оставшуюся в сосудистом русле после кровопотери. Что касается изменений в количестве лейкоцитов и лейкоцитарной формулы, то достоверных различий в них при повреждении полых, паренхиматозных органов, изолированной травме брюшной стенки и экстраабдоминальных повреждениях не выявлено (Е. А. Вагнер, М. Г. Урман, 1987). Однако данное исследование необходимо. Диагностическая значимость его возрастает при динамическом контроле и, кроме того, отражает тяжесть течения травматической болезни.
Анализ мочи имеет смысл проводить лишь при отсутствии макрогематурии. При обнаружении крови в моче уровень и тяжесть повреждения мочевыводящих путей уточняются другими методами исследования. Если пострадавший находится в бессознательном состоянии, тяжелом шоке или имеются дизурические явления, то предпринимается катетеризация мочевого пузыря. При этом может оказаться, что количество выделенной мочи (иногда цвета мясных помоев) значительно превышает емкость мочевого пузыря — симптом Зельдовича, что характерно для внутрибрюшинного разрыва пузыря.
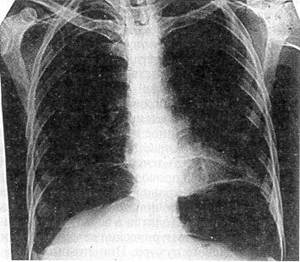 |
| Рис. 30. Обзорная рентгенограмма груди и живота больной Л, 38 лет, с разрывом подвздошной кишки суточной давности свободный воздух в брюшной полости |
Практически всем пострадавшим должна выполняться обзорная рентгенография живота, а при необходимости — и других анатомических областей При тяжелом состоянии пострадавшего исследование проводится в реанимационном отделении или на операционном столе; обязательно обзорное исследование грудной и брюшной полостей при горизонтальном положении больного; при необходимости делается еще снимок в латеропозиции — на здоровом боку. Этот доступный, неинвазивный метод исследования позволяет не только выявить воздух в свободной брюшной полости (рис. 30), но и при приобретении навыков чтения снимков распознать внутрибрюшное кровотечение: уровни жидкости, симптом «всплывания» кишечника При повреждении печени отмечаются нечеткость нижнего края органа из-за наличия сгустков крови в подпеченочном пространстве, высокое стояние правой половины диафрагмы и даже расширение и гомогенное затемнение правого латерального канала Сходные изменения выявляются при травме селезенки, но уже слева Образование периспленальной гематомы вызывает смещение пнев-матизированного желудка вправо и вниз (М К Щербатенко и соавт, 1975, 1986) О наличии забрюшинной гематомы свидетельствует гомогенное плотное затемнение соответствующей стороны при отсутствии четкости контуров почки и поясничной мышцы (рис 31) Патогномоничным симптомом разрыва забрюшинного отдела двенадцатиперстной кишки является картина ретропневмопе-ритонеума — забрюшинной «эмфиземы» (рис 32) Обзорная рентгенография позволяет выявить разрыв диафрагмы и смещение органов
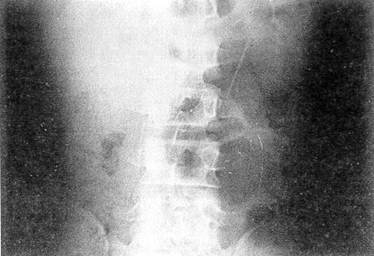
Рис. 31. Обзорная рентгенограмма брюшной полости больного Г, 42 лет,
с разрывом правой почки отсутствует изображение наружного контура поясничной
мышцы справа, видна тень гематомы забрюшинного пространства
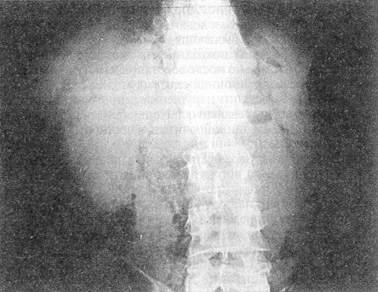
Рис. 32. Обзорная рентгенограмма брюшной полости больного В, 34 лет, с разрывом забрюшинного отдела двенадцатиперстной кишки воздух в забрюшинном
пространстве
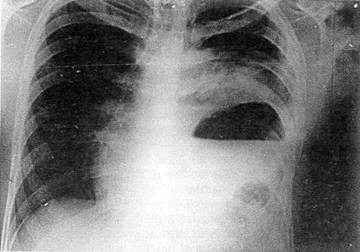
Рис 33 Обзорная рентгенограмма груди и живота больного И, 29 лет, с сочетанной закрытой травмой груди и живота видна деформация левой половины грудной клетки вследствие переломов ребер, разрыв диафрагмы — желудок и петли
кишечника в плевральной полости, органы средостения смещены вправо
брюшной полости в плевральную, что более наглядно при разрыве левого купола диафрагмы (рис. 33).
Рентгеноконтрастное исследование органов мочевыделительной системы проводится, если выявлены симптомы ее повреждения. Так, наличие гематурии служит показанием к экскреторной урографии, которая выполняется только после восстановления показателей гемодинамики. Чашечно-лоханочная система может оказаться неконт-растированной из-за резкого нарушения секреторной функции почек — так называемая шоковая почка. Неинформативна урография при повышенной пневматизации кишечника, в частности, на фоне забрюшинной урогематомы.
Уточнить тяжесть повреждения почки позволяет ангиография (рис. 34). Отношение к ангиографии неоднозначное. Одни клиницисты (М. К. Щербатенко и соавт., 1973; Л. С. Зингерман, Т. А. Ахадов, 1986) применяют аорто- и целиакографию для топической диагностики повреждений органов брюшной полости даже у пострадавших, госпитализированных с клиникой продолжающегося внутрибрюшного кровотечения, проводя одновременно противошоковую терапию; другие (и их большинство) — только при стабильных показателях гемодинамики для распознавания травмы почки, субкапсулярного разрыва селезенки, печени, причем у больных с клиникой гемобилии при обнаружении внутрипечёночной гематомы осуществляется эндоваскулярная эмболизация кровоточащего сосуда (В. С. Шапкин и соавт., 1987; Г. Н. Цыбуляк, 1985, 1995).
Известно, что у 10% пострадавших с переломами костей таза об-
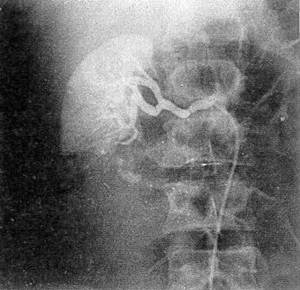
Р и с 34 Ангиограмма правой почки больного В, 32 лет ангиографическая картина отрыва нижнего полюса почки
наруживаются повреждения мочевого пузыря или уретры (I. Antoci, М. Schiff, Iγ., 1983). Наличие макрогематурии является угрожающим симптомом, свидетельствующим о необходимости исключить повреждение нижних отделов мочевых путей. С этой целью применяется ретроградная уретероцистография. Катетеризация мочевого пузыря допустима только эластическим катетером, смазанным стерильным вазелиновым маслом. При ощущении малейшего препятствия продвижению катетера манипуляцию следует прекратить, чтобы частичное повреждение уретры не превратилось в полный ее разрыв. Для цистографии можно использовать любой стерильный водорастворимый контраст 10—15% концентрации, приемлемый и для экскреторной урографии, в объеме не менее 250—300 мл («тугая» цистография). Рентгеновские снимки выполняются при наполненном мочевом пузыре — в фасной и косой проекции, а также после его опорожнения — для выявления затеков контрастного вещества (рис. 35, 36); при интактном пузыре количество выведенного раствора соответствует количеству введенного.
Рентгеноконтрастное исследование желудочно-кишечного тракта целесообразно, если возникло предположение о разрыве диафрагмы с перемещением в плевральную полость полых органов: желудка, селезеночного изгиба ободочной кишки, а иногда и петель тонкой кишки; пункция и тем более дренирование плевральной полости в такой ситуации чревато опасностью возможного ятрогенного повреждения органов. Полипозиционное исследование контрастированного желудка позволяет обнаружить скопление жидкости в сальнико-
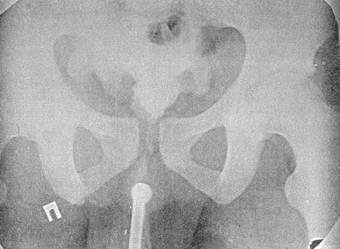
Рис. 35. Цистограмма больного В, 22 лет, с внутрибрюшинным разрывом мочевого
пузыря виден затек контрастного вещества в свободную брюшную полость,
имеется перелом лонной и седалищной костей справа
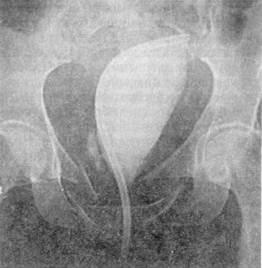
Рис. 36. Цистограмма больного С, 46 лет, с внебрюшинным разрывом мочевого
пузыря мочевой пузырь сдавлен гематомой, отмечается затек раствора контраста
в паравезикальную клетчатку, виден оскольчатый перелом лонных
и седалищных костей
вой сумке как следствие травмы поджелудочной железы, а также периспленальную гематому. Для исключения разрыва забрюшинного отдела двенадцатиперстной кишки пострадавшему дают выпить водорастворимое контрастное вещество или оно вводится через назогастральный зонд; затек контрастного вещества за контуры кишки свидетельствует о ее разрыве.
Радионуклидное сканирование проводится относительно редко пострадавшим со стабильной гемодинамикой, преимущественно для диагностики субкапсулярных разрывов паренхиматозных органов и контроля за течением в них репаративных процессов.
Компьютерная томография по разрешающей способности имеет преимущества перед радиоизотопным исследованием. С ее помощью хирург получает достоверное представление о тяжести повреждений паренхиматозных органов и развившихся осложнений в брюшной полости и забрюшинном пространстве; возможен отбор больных с незначительными повреждениями, которых можно лечить консервативно, а это имеет особую значимость при сочетанной травме. Необходимым условием исследования являются стабильные показатели гемодинамики. Компьютерная томография очень важна для динамического наблюдения за развитием внутриорганных и субкапсулярных гематом паренхиматозных органов, выявленных при ультразвуковом исследовании (М. М. Абакумов и соавт., 2002).
Ультразвуковое исследование более доступно по сравнению с компьютерной томографией, необременительно для больного, занимает мало времени и так же высокоинформативно. С его помощью можно обнаружить свободную жидкость в брюшной полости, разрывы и гематомы паренхиматозных органов, распознать послеоперационные осложнения: перитонит, абсцессы различной локализации, забрюшинную флегмону (В. Л. Карташкин, 2001; В. И. Картавенко и соавт., 2001). Чувствительность ультразвукового исследования при определении гемоперитонеума у пострадавших с сочетанными повреждениями живота составляет 87,4%; в НИИ скорой помощи им. Н. В. Склифосовского сонография считается скрининговым методом диагностики повреждений живота и большинству больных проводится в течение 30 мин с момента госпитализации (М. М. Абакумов и соавт., 2002).
Ограниченность во времени для выявления ведущего, определяющего тяжесть состояния пострадавшего повреждения, особенно при массовых повреждениях, заставляет хирурга применять и инвазивные инструментальные методы экспресс-диагностики. Простым по технике выполнения и легко переносимым методом исследования, позволяющим ответить на главный вопрос: «Есть или нет повреждение органов живота?», является лапароцентез, разрешающая диагностическая способность которого 73—98% (А. Н. Беркутов, И. И. Дерябин, 1976; Е А. Вагнер и соавт, 1978; И. 3. Козлов и соавт., 1983; М. М. Абакумов и соавт., 1991; М. Krausz et al., 1981). Частота применения лапароцентеза у пострадавших с сочетанной травмой колеблется от 21,5—48% (В. А. Закурдаев, 1976; Ю. Г. Шапошников и со-
авт., 1980; М. Г. Урман, 1993) до 60,9—100% (Л. Н. Бенеско и соавт., 1988; P. Lorgeron et al., 1983). Лапароцентез показан пострадавшим, поступившим в состоянии тяжелого шока, мозговой комы, когда механизм травмы не исключает возможности повреждения органов брюшной полости, при необъяснимом снижении артериального давления и прогрессирующей анемии, травме груди, позвоночника, таза, если на основании клинической картины дифференциальная диагностика затруднена. Следует учесть, что у пострадавших с переломом костей таза частота ложноположительных результатов достигает 23%, что объясняется поступлением крови в брюшную полость из забрюшинного пространства через поврежденный листок брюшины или проколом троакаром брюшной стенки через гематому (В. Э. Дубов, 1987). Незначительное количество крови может быть следствием разрыва капсулы печени, селезенки, надрыва брыжейки кишки и еще не является показанием к экстренному оперативному вмешательству. Такой результат лапароцентеза свидетельствует, что тяжесть состояния пострадавшего обусловлена повреждением другой анатомической области и врачу необходимо продолжить обследование. Аргументированной следует считать тактику клиницистов, которые в ситуациях, когда на основании клинической картины и данных физикального исследования нельзя исключить повреждение органов брюшной полости, а результаты лапароцентеза сомнительные или отрицательные, трансформируют последний в лапароскопию (Ф. Н. Ромашов и соавт., 1984; В. В. Тимошенко, 1987).
Лапароскопия — более сложное в выполнении исследование, разрешающая способность которого составляет 98% (М. М. Абакумов и соавт., 1991; К. Lautering et al., 1987). Под разрешающей способностью подразумевается не установление топического диагноза (это не всегда возможно), а распознавание внутрибрюшной катастрофы и решение вопроса о необходимости (и срочности) оперативного вмешательства. Лапароскопия позволяет уточнить тяжесть повреждения печени, селезенки, поджелудочной железы и при легкой травме этих органов провести санацию и дренирование брюшной полости и сальниковой сумки, т. е. избежать лапаротомии, что существенно улучшает результаты лечения пострадавших с сочетанной травмой (Ю. В. Бирюков и соавт., 1995; А. И. Корабельников, С. В. Аксенова, 1995). С осторожностью следует применять лапароскопию пострадавшим с сочетанной травмой живота и груди: создание пневмоперитонеума для них небезопасно; напротив, при сочетанной травме живота и таза лапароскопия является методом выбора; полученная с ее помощью информация наиболее достоверна и позволяет определиться в лечебной тактике.
Внедрение в клиническую практику инструментальных методов диагностики не только резко уменьшило количество напрасных лапаротомий, при которых летальность составляла 35%, но и обеспечило возможность раннего оперативного вмешательства (В. В. Тишенко, 1987). Однако существует предел разрешающей диагности-
ческой возможности и для лапароскопии. Так, при первичном лапароскопическом исследовании нельзя исключить небольшие по размеру повреждения полых органов и предлагается контрольные исследования проводить через фторпластиковую гильзу, оставляемую в брюшной стенке (А. Н. Хорев и соавт., 1998). Следует отметить, что в некоторых клиниках ультразвуковое исследование уже вытеснило лапароцентез и лапароскопию в диагностике повреждений живота (В. И. Картавенко и соавт., 2001). В то же время справедливы утверждения авторов, полагающих, что, выявив с помощью ультразвукового исследования жидкость в свободной брюшной полости, невозможно определить ее характер. Поэтому при переломах костей таза, когда кровь из забрюшинного пространства через небольшой дефект в париетальной брюшине поступила в брюшную полость, лапаротомия может оказаться напрасной (Г. А. Костюк, 2001).
Принципиальным положением диагностической программы является сочетание активного диагностического поиска с поэтапной неотложной коррекцией всех угрожающих жизни последствий травмы (И. А. Ерюхин и соавт., 1996; П. Г. Брюсов и соавт., 2001). При этом следует свести до минимума инвазивные, трудоемкие методы исследования, связанные с необходимостью перемещения пострадавшего и значительной затратой времени.
Продолжительность и характер противошоковой терапии, последовательность и объем оперативного вмешательства в отношении пострадавших с сочетанной травмой живота являются ключевыми вопросами этой сложной проблемы, которая обсуждалась на многочисленных форумах хирургов и в печати.
При сочетанной закрытой травме живота и груди большинство хирургов придерживаются активной тактики в отношении травм живота и сдержанной — в отношении повреждений груди (Е. А. Вагнер, 1981, В. А. Брунс, 1993; С. Christophi, 1983). Торакотомия предшествует лапаротомии только при наличии жизнеугрожающих повреждений органов груди: разрыва сердца, крупных сосудов с картиной большого или быстро прогрессирующего гемоторакса, бронхов с развитием гипертензивной эмфиземы средостения и клиникой нарастающей экстраперикардиальной тампонады сердца. В большинстве случаев удается ограничиться срединной лапаротомией, позволяющей провести тщательную ревизию брюшной полости и произвести в полном объеме корригирующие вмешательства на органах брюшной полости, а при выявленном разрыве диафрагмы — ее ушивание; при наличии гемопневмоторакса лапаротомии предшествует дренирование плевральной полости. Показаниями к торакотомии после лапаротомии служат напряженный пневмоторакс, не устраненный дренированием, а также стойкий коллапс легкого в течение 3—5 сут, продолжающееся внутриплевральное кровотечение с выделением крови по дренажу в количестве 200—250 мл/ч в течение 3 ч, тампонада сердца (А. П. Кузьмичев и соавт., 1980; В. А. Брунс, 1993; К. Lautering et al., 1987).
При сочетанной травме головы и живота у пострадавших с кли-
никой нарастающей субдуральной гематомы или находящихся в коматозном состоянии со стволовыми нарушениями, если внутрибрюшная катастрофа обусловлена перитонитом, рациональнее начать операцию с трепанации черепа, а уже затем выполнить лапаротомию. Напротив, на фоне продолжающегося кровотечения в брюшную полость тактика в отношении срочности ликвидации внутричерепных осложнений сдерживающая; считается, что первоначальное обеспечение хирургического гемостаза в брюшной полости, уменьшая гемоциркуляторные и ликвородинамические нарушения, приобретает дифференциально-диагностическое значение для уточнения ведущей причины декомпенсации состояния пострадавшего и позволяет более достоверно судить о тяжести повреждения черепно-мозгового слагаемого травмы (С. А. Павло-вичев, 1984; А. Е. Дунаевский и соавт., 1986; П. В. Ильин, 1986; А. С. Денисов, 1993). В исключительно редких случаях при отчетливом дислокационном синдроме и клинике внутрибрюшного кровотечения практикуется проведение вмешательства двумя бригадами одновременно (С. 3. Горшков и соавт., 1986). Некоторые хирурги считают, что в период шока, даже при наличии признаков сдавления головного мозга, следует ограничиться только наложением фрезевых отверстий (Б. В. Артемьев и соавт., 1985).
Пострадавшие с тяжелой травмой таза обычно находятся в состоянии шока смешанного генеза — травматического и обусловленного кровотечением в забрюшинное пространство. Источниками кровотечения могут быть пресакральные, превезикальные венозные сплетения, спонгиозное вещество костного остова таза в области заднего полукольца и вертлужной впадины, ветви внутренней подвздошной артерии (В. Е. Розанов, Л. П. Бондаренко, 2001). Следует признать аргументированной тактику клиницистов, которые при выявлении повреждений органов брюшной полости считают показанным экстренное оперативное вмешательство только в ситуациях, требующих достижения хирургического гемостаза при продолжающемся кровотечении в брюшную полость или забрюшинное пространство, а в других случаях целесообразно проводить противошоковую терапию до стабилизации показателей гемодинамики (Г. С. Юмашев и соавт., 1986; М. Г. Урман и соавт., 2000; J. Palmer et al., 1983). По их мнению, при повреждении кишечника операцию можно отложить на 2 ч, а при повреждении мочевого пузыря — до 6 ч. Стабилизация гемодинамики невозможна без адекватного лечения острой кровопотери гемотрансфузией, переливанием свежезамороженной плазмы, коллоидных растворов (И. П. Дуданов и соавт., 2000). Важным компонентом противошоковой терапии является борьба с болью. С этой целью обычно применяется внутритазовая анестезия по Школьникову — Селиванову 0,25% раствором новокаина по 150 мл с каждой стороны при двустороннем переломе или по 150—200 мл при одностороннем, анестезия мест переломов переднего полукольца таза. В. С. Гостев (1972) при отсутствии эффекта от проводимых в течение часа реанимационных мероприятий перевязывал магист-
ральные сосуды таза — внутренние подвздошные артерии, предпочтение автор отдает чрезбрюшинному доступу, позволяющему провести ревизию брюшной полости и обеспечивающему свободу манипуляций при перевязке обеих внутренних подвздошных артерий. Наибольший опыт перевязки внутренних подвздошных артерий при травме таза накоплен в клинике ВПХ военно-медицинской академии им. С. М. Кирова (Э. В. Чернов, В. В. Сорока, 1987). Согласно данным Э. В. Чернова, В. В. Сороки, гемостаз достигнут у всех 32 пострадавших, перенесших это вмешательство, однако 17 из них умерли в первые 12 ч от тяжести травмы, шока и необратимой кровопотери, еще 4 умерли в течение недели от других осложнений травматической болезни; выздоровели 11 человек. На основании клинических наблюдений и экспериментальных исследований (опыты проведены на 30 собаках) авторы пришли к заключению, что перевязка внутренних подвздошных артерий является эффективным способом гемостаза при травме таза, а функциональные и морфологические изменения в мочевом пузыре и прямой кишке носят обратимый характер. И все же В. Е. Розанов и Л. П. Бондаренко (2001) предпочитают не перевязывать внутренние подвздошные артерии, а ограничиваются наложением на сосуды турникетов. Они считают, что хирургическая тактика должна предусматривать и непосредственное воздействие на источники кровотечений в сочетании с коррекцией структурных нарушений тазового кольца. Если источник кровотечения спонгиозное вещество, то предлагается стабилизировать тазовое кольцо аппаратом внешней фиксации с одновременной лапаротомией и наложением турникетов на внутренние подвздошные артерии с репозицией тазового кольца до смыкания краев костных ран заднего отдела. После достижения гемостаза турникет снимают, а при возобновлении кровотечения выводят на переднюю брюшную стенку и снимают уже в отсроченном периоде (В. Е. Розанов, Л. П. Бондаренко, 2001). И. П. Дуданов и соавт. (2000) при переломах костей таза, сопровождающихся шоком и ретроперитонеальной гематомой, рекомендуют выполнять артериографию и в случае выявления травм магистральных сосудов предпринимать экстренную лапаротомию, а при повреждении дистальных сосудов ограничиться эмболизацией внутренней подвздошной артерии.
Лечение переломов у пострадавших с сочетанной травмой живота должно быть малотравматичным, но в то же время эффективным. А. В. Каплан и соавт. (1985) у 86% пострадавших в остром периоде травматической болезни ограничились скелетным вытяжением или гипсовой повязкой. После выведения из тяжелого состояния 2/3 больных методы лечения переломов были изменены: наложены аппараты внеочаговой чрескостной фиксации или произведен металлоостеосинтез. Сторонники активной тактики, напротив, считают, что раннее оперативное вмешательство по поводу переломов костей конечностей, обеспечивая обездвиживание отломков, способствует выведению пострадавшего из шока, облегчает уход за ним, снижает летальность и число послеоперационных
осложнений (В. Ф. Трубников и соавт., 1984; С. С. Ткаченко,
A. Е. Евдокимов, 1990; А. С. Ермолов, 2003). Так, согласно сооб
щению Т. Я. Бескиеру и соавт. (1988), среди пострадавших, кото
рым в остром периоде травматической болезни применили остео
синтез аппаратом Г. А. Илизарова, осложнения составили 27,7%,
летальность — 30,1%, а среди леченных консервативными метода
ми соответственно 61 и 41,7%. Высказывания некоторых хирур
гов еще более категоричны, а именно: лечение переломов длин
ных костей при сочетанных повреждениях методом скелетного вы
тяжения они считают недопустимым; предпочтение отдается вне-
очаговому остеосинтезу, выполненному в течение первых суток
с момента травмы (А. Б. Слободской, Е. Ю. Осинцев, 2001;
Д. И. Фадеев, В. В. Ковындиков, 2001). Внутрикостному остеосин
тезу отдавалось предпочтение лишь на бедре. Оптимальным сроком
для оперативного вмешательства авторы считают 1—2-е сутки с
момента травмы — период первичной или кратковременной ком
пенсации. Противопоказанием к раннему остеосинтезу является
явное нарушение жизненно важных функций организма (сердечно
сосудистой и дыхательной систем), но не отсутствие сознания.
B. Г. Радыш и Ю. Б. Кашанский (2000) при определении времени,
объема и характера травматологического пособия тяжело постра
давшему ориентируются на прогностический критерий длительно
сти интенсивной терапии шока, разработанный Ю. Н. Цибиным
(1975). Так, интрамедуллярный металлоостеосинтез при диафизар-
ных переломах проксимальных отделов бедра и плеча они выпол
няют после выведения из шока пострадавших с благоприятным для
оперативного лечения прогнозом (до +12 ч), а пострадавшим других
групп — в отсроченном и плановом порядке. Накостный остеосин
тез производят по тем же показаниям, но в отличие от интраме-
дуллярного он обеспечивает более жесткую фиксацию отломков и
не требует дополнительных средств иммобилизации.
Пострадавшим с отрывами сегментов конечностей и клинической картиной продолжающегося внутрибрюшного кровотечения до лапаротомии только временно останавливают кровотечение с помощью кровоостанавливающих зажимов (Ф. В. Горяинов и соавт., 1980). Напротив, при отсутствии данных, свидетельствующих о продолжающемся внутрибрюшном кровотечении и размозжении сегмента конечности с нежизнеспособностью дистального отдела, лапаротомии должна предшествовать ампутация, которую следует рассматривать как компонент противошоковой терапии. Такова же тактика и при отрывах конечностей, если невозможна первичная реконструктивная операция. В тех же ситуациях, когда реимплантация дистального отдела конечности возможна и повреждение органов брюшной полости также факт установленный, оперативное вмешательство проводится двумя бригадами хирургов одновременно (И. П. Дуданов и соавт., 2000).
Хирургическая тактика в отношении пострадавших с сочетанной травмой живота, сопровождающейся шоком, должна основываться на
данных прогноза степени тяжести и течения травматического шока. Прогнозирование продолжительности и исхода травматического шока особенно важно при массовом поступлении пострадавших, так как позволяет определиться в сроках, объеме оперативного вмешательства и даже в его целесообразности, а также составить программу инфузионно-трансфузионной терапии и наметить меры профилактики осложнений (М. Г. Урман, А. В. Одинцов, 1997; П. Г. Брюсов и соавт., 2001).
Все массовые катастрофы отличает одна особенность — несоответствие между количеством пострадавших и возможностями оказания медицинской помощи (Л. Ю. Эскина и соавт., 1985). В этих условиях методы прогнозирования позволяют врачу четко распределить пострадавших по тяжести состояния, отдать приоритет тем, кто может выжить.
Вопросы прогнозирования разрабатывались многими клиницистами, причем одни исследователи рассчитывали прогноз на основе количества и тяжести повреждения анатомических областей (S. Baker et al., 1974), другие — только на основе физиологических параметров (С. Herve et al, 1987). Точность прогноза существенно повышается при одновременном учете как характера и локализации повреждений, так и функциональных тестов, отражающих реакцию пострадавшего на травму (Ю. Н. Цибин, 1981; И. В. Гальцева и соавт., 1986; Ю. Б. Шапот и соавт., 1990). Эффективность прогнозирования возрастает при использовании базы данных, содержащей сведения о большом количестве пострадавших, что позволяет провести объективный сравнительный анализ различных вариантов лечебной тактики (Г. И. Назаренко и соавт., 1991). Отечественная система прогнозирования основана на использовании частотно-регрессионного метода, исключающего субъективизм при количественной оценке тяжести травм (Г. И. Назаренко и соавт., 1990; Ю. Г. Шапошников и соавт., 1990; С. Ф. Багненко и соавт., 2001).
Проведен анализ результатов лечения 347 пострадавших, имеющих сочетанную закрытую травму живота с повреждением органов брюшной полости: мужчин — 241 (69,4%), женщин — 106 (30,6%). Большинство (86,8%) пострадавших — трудоспособного возраста. Травму получили: при разнообразных транспортных происшествиях — 197 (56,8%) человек (автодорожные — 168, железнодорожные — 29), при падении с высоты — 57 (16,4%), сдавлении тела — 11 (3,2%); бытовая травма — 82 (23,6%) наблюдения. Наиболее часто травма живота сочеталась с повреждениями груди (220) и головы (186), реже — таза (95), конечностей (84) и позвоночника (18). Варианты сочетания повреждений анатомических областей и их исход представлены в таблице 17.
Паренхиматозные органы были повреждены у 230 (66,3%) человек, полые — у 43 (12,4%), паренхиматозные и полые — у 74 (21,3%).
Таблица 17
Варианты сочетания повреждений анатомических областей у пострадавших с сочетанной закрытой травмой живота и их исход
| Поврежденные области | Кол-во больных | Умерло |
| Живот — грудь | ||
| Живот — голова | ||
| Живот — таз | ||
| Живот — конечности | ||
| Живот — позвоночник | — | |
| Живот — грудь — голова | ||
| Живот — грудь — таз | ||
| Живот — голова — конечности | ||
| Живот — голова — таз | ||
| Живот — таз — конечности | ||
| Живот — грудь — конечности | ||
| Живот — грудь — позвоночник | — | |
| Живот — голова — позвоночник | — | |
| Живот — голова — грудь — конечности | ||
| Живот — голова — грудь — таз | ||
| Живот — голова — грудь — позвоночник | ||
| Живот — голова — позвоночник — конечности | ||
| Живот — голова — таз — конечности | — | |
| Живот — грудь — таз — конечности | ||
| Живот — грудь — таз — позвоночник | ||
| Живот — голова — грудь — позвоночник — конечности | ||
| Живот — голова — грудь — таз — конечности |
Шок разной степени тяжести констатирован у 272 (78,4%) пострадавших: 1-й степени — у 45, 2-й — у 66, 3-й — у 124, 4-й — у 37; кровопотеря оказалась основной причиной развития шока у 253 (93%) больных. Травма живота была ведущим повреждением у 220 (63,4%) человек и конкурировала по тяжести с повреждениями других анатомических областей еще у 48 (13,8%) пострадавших.
Распознавание внутрибрюшной катастрофы у пострадавших с сочетанной закрытой травмой живота было сложной задачей из-за крайней тяжести их состояния, атипичности клинической картины, недостатка времени для углубленного обследования. Контакт со многими больными был невозможен, так как у 166 (19%) человек созна-
ние оказалось утраченным полностью, а у 38 (10,9%) — частично; кроме того, 143 (41,2%) пострадавших находились в алкогольном опьянении. И все же у большинства (59,1%) пострадавших повреждения органов брюшной полости диагностированы на основании анализа обстоятельств травмы, клинической картины и данных физикального исследования. Показания к применению вспомогательных методов исследования, их разрешающая диагностическая способность соответствовали данным в литературном обзоре.
Сочетанная закрытая травма живота и груди (220 чел.) отличалась особой тяжестью, что объясняется наличием у большинства (65%) больных массивного внутрибрюшного кровотечения из-за повреждения паренхиматозных орг
 2015-03-08
2015-03-08 2256
2256








