Вещества, составляющие раствор, делят на растворенные вещества и растворитель, где последний находится в растворе в большом количестве и определяет его агрегатное состояние. В лабораторной практике наиболее распространены жидкие растворы, где растворителем является жидкость, чаще всего вода.
Количественный состав раствора задают с помощью концентраций - характеристик раствора, определяющих пропорции, в которых смешаны растворенные вещества и растворитель. Существуют весовые и объемные способы задания концентрации растворов.
Обозначим: А – растворенное вещество, В – растворитель.
Определение 1. Массовой долей растворенного веществаw(А) называется отношение его массы m(A) к массе раствора mр-р:
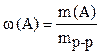 , где 0 <
, где 0 < 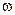 (А) < 1
(А) < 1
Безразмерную величину 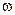 (А) часто выражают в процентах:
(А) часто выражают в процентах: 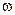 (A)%=
(A)%= 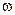 (A) · 100%
(A) · 100%
Поскольку 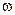 (А) +
(А) + 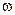 (В) = 1, то массовая доля растворителя может быть легко определена по уравнению:
(В) = 1, то массовая доля растворителя может быть легко определена по уравнению: 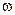 (B) = 1 -
(B) = 1 - 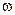 (A).
(A).
Можно получить другие удобные формы записи определения 1, если использовать очевидные соотношения для массы раствора:
|
|
|
mр-р= m(A) + m(B) или mр-р.= Vр-р[мл] × r[г/мл],
гдеVр-р– объем раствора; rр-р- его плотность.
Итак, 
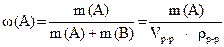 ,
,
а массы растворенного вещества А и растворителя В в растворе легко могут быть найдены по формулам:
m(A) = mр-р · w(А) = Vр-р.· rр-р · 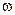 (А)
(А)
m(B) = mр-р - m(A) = mр-р · (1 - 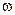 (А))
(А))
Определение 2 Молярную концентрацию растворенного вещества с(А) рассчитывают как отношение количества вещества n(А) [моль] к объему раствора Vр-р [л], выраженному в литрах, и она показывает число моль А, приходящееся на 1 литр раствора:
с(A)[моль/л] = 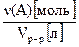 , откуда
, откуда 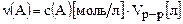
Для сокращения записи размерность молярной концентрации [моль/л] часто заменяют буквой М, например
с(А) = 0,1 моль/л = 0,1М.
На практике широко используют массовую (весовую) объемную концентрацию сm(А), определяемую как отношение массы растворенного вещества m (А), выраженной в граммах, миллиграммах и др., к объему раствора Vр-р [л], выраженному в литрах:
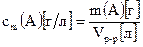 и тогда m(A) = сm(A)[г/л] · Vр-р[л]
и тогда m(A) = сm(A)[г/л] · Vр-р[л]
Между концентрациями  (A), с(А)[моль/л] и cm(A)[г/л] существует связь:
(A), с(А)[моль/л] и cm(A)[г/л] существует связь:
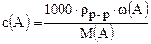 и
и 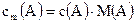 , с другой стороны
, с другой стороны 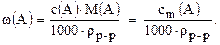
Для твердых и газообразных растворенных веществ существует предельное количество, которое при данных условиях может быть растворено в определенной массе или объеме растворителя. Образующийся при этом раствор называется насыщенным, а его концентрация соответствует растворимости данного вещества.
В справочниках из соображений удобства растворимость веществ S при разных условиях выражают не в виде концентраций насыщенных растворов 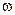 (А) или с(А), а указывают для твердых веществ – массу вещества А, растворимую в 100г растворителя (Н2О) при температуре t°C [г/100г Н2О]; для газообразных веществ – объем газа, растворимого в 1л растворителя (Н2О) при температуре t°C и давлении Р[Па] – [л/1 л Н2О]. Например, растворимость хлорида калия в 100г воды при 25°С обозначается S (KCl) = 36,025. На основе этих данных легко рассчитать обычные концентрации
(А) или с(А), а указывают для твердых веществ – массу вещества А, растворимую в 100г растворителя (Н2О) при температуре t°C [г/100г Н2О]; для газообразных веществ – объем газа, растворимого в 1л растворителя (Н2О) при температуре t°C и давлении Р[Па] – [л/1 л Н2О]. Например, растворимость хлорида калия в 100г воды при 25°С обозначается S (KCl) = 36,025. На основе этих данных легко рассчитать обычные концентрации 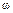 (А) и с(А) насыщенных растворов.
(А) и с(А) насыщенных растворов.
|
|
|
Например, 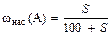 .
.
Следует отметить, что растворимость твердых веществ обычно растет с ростом температуры, а растворимость газов растет при уменьшении температуры и росте его давления над раствором.
Пример 1. При химическом анализе ионного состава пробы природной воды обычно определяют содержание каждого иона в отдельности, а правильность анализа в целом проверяют на основе условия электронейтральности раствора. Например, на этикетке слабогазированной минеральной воды «Нижне-Ивкинская № 2 К» представлен ее состав (в мг/л):
| гидрокарбонаты | 100 – 300 | натрий + калий | 100 – 200 |
| хлориды | 100 – 200 | магний | 50 – 100 |
| сульфаты | 1200 – 1500 | кальций | 400 – 800 |
| минерализация (общая масса растворенных солей) | 2,2 – 3,0 г/л |
1) Запишите состав минеральной воды с помощью химических символов и перейдите от концентрации мг/л к ммоль/л (1 ммоль = 10-3моль), что необходимо для выполнения последующих заданий.
2) Природная вода имеет обычно переменный состав, поэтому на этикетке указаны возможные интервалы содержания каждого компонента минеральной воды. С другой стороны, результаты химического анализа конкретной пробы воды должны удовлетворять условию электронейтральности раствора. Составьте условие электронейтральности, соответствующее качественному составу 1 л данной минеральной воды.
3) Предложите один из возможных составов минеральной воды, который бы подчинялся условию электронейтральности и не противоречил бы составу на этикетке (пусть, например, вода имеет минимальные жесткость и содержание сульфатов, среднее содержание хлоридов и гидрокарбонатов и нулевое содержание калия). Какие соли и в каком количестве необходимо взять для искусственного приготовления 1м3 минеральной воды предложенного Вами состава? Вычислите минерализацию приготовленной воды.
Запишем состав минеральной воды, перейдя от концентрации мг/л к ммоль/л:
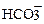
| (61 г/моль) | 1,64 - 4,92 |
| Cl - | (35,5 г/моль) | 2,82 - 5,63 |
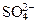 
| (96 г/моль) | 12,6 - 15,63 |
| Nа+ + К+ | (23 г/моль, 39 г/моль) | х / 23; (100-х) / 39 у / 23; (200-у) / 39, где хи у- массы Nа+, мг |
| Mg2+ | (24 г/моль) | 2,08 - 4,17 |
| Са2+ | (40 г/моль) | 10,0 - 20,0 |
Условие электронейтральности раствора электролитов: суммарный заряд катионов равен по величине суммарному заряду анионов, тогда для 1 л минеральной воды получаем:
1×С(Nа+) + 1×С(К+) + 2×С(Mg2+) + 2×С(Cа2+) =
= 1×С(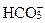 ) + 1×С(Cl -) + 2×С(
) + 1×С(Cl -) + 2×С(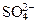 ),
),
где С - молярная концентрация иона, ммоль/л или моль/л.
Приготовим, например, минеральную воду с характеристиками, указанными в условии задачи (минимальная жесткость воды соответствует минимальному содержанию в ней ионов Cа2+, Mg2+) в расчете на 1 л:
| катионный состав, ммоль | анионный состав, ммоль |
| n (Cа2+) = 10 n (Mg2+) = 2,08 n (Nа+) = 8,54 – расчет по уравнению электронейтральности | n (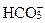 ) = 3,28
n (Cl -) = 4,22
n ( ) = 3,28
n (Cl -) = 4,22
n (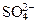 ) = 12,6 ) = 12,6
|
| суммарный заряд катионов: +32,7 ммоль | суммарный заряд анионов: - 32,7 ммоль |
Составим формулы солей и определим их количества, необходимые для приготовления 1л минеральной воды (возможны разные варианты солевого состава, но суммарное количество каждого иона с учетом его содержания во всех солях должно соответствовать приведенной выше таблице):
гидрокарбонат натрия – 3,28 ммоль, сульфат натрия – 2,63 ммоль, сульфат магния – 2,08 ммоль, хлорид кальция – 2,11 ммоль, сульфат кальция – 7,89 ммоль, что в пересчете на массу солей для 1000 л воды составляет соответственно:
275,5 г + 373,5 г + 249,6 г + 234,2 г + 1073,0 г = 2205,8 г
Минерализация минеральной воды будет 2,2 г/л.
(Примечание: Повышенная растворимость сульфата кальция обеспечивается солевым эффектом минеральной воды
|
|
|
Расчеты при приготовлении, разбавлении и смешении растворов одного и того же вещества объединяет одна общая идея – во всех случаях записывают уравнения материального баланса, связывающие характеристики конечного раствора и его исходных составляющих. В результате получают систему из двух алгебраических уравнений и, решая ее, определяют искомые характеристики конечной смеси или массы (объемы) исходных составляющих, которые необходимо взять для приготовления раствора с заданными характеристиками.
В расчетах с использованием массовой доли w(А) основу составляют два закона сохранения массы – относительно смеси и относительно растворенного вещества, составленные на основе характеристик составных частей I и II и самой смеси:
– баланс по массе смеси: m(I) + m(II) = m(смесь)
– баланс по массе растворенного вещества:
m(A / I.) + m(A / II) = m(A / смесь)
Далее величины, представленные в этих уравнениях, выражают согласно условию задачи через объемы, плотности и массовые доли растворенного вещества соответствующих растворов.
Заметим, что закон сохранения объема при смешении растворов в общем виде не выполняется, то есть объем смеси не всегда равен сумме объемов исходных растворов (см. пример 3).
В расчетах с использованием молярной концентрации с(А) основу составляют точный закон сохранения количества вещества и приближенно выполняющийся закон сохранения объема смесив случае разбавления и смешения растворов. Последний соблюдается тем точнее, чем более разбавлены смешиваемые растворы.
– баланс по объему смеси при разбавлении и смешении:
V(I) + V(II) @ V(смесь)
– баланс по количеству растворенного вещества:
n(A / I) + n(А / II) = n(А / смесь)
или с(А/ I)·V(I) + c(А/ II)·V(II) = c (А / смесь)·V(смесь)
Пример 2. Какие объемы газообразного аммиака (н.у.) и его раствора с w(NH3) = 3% и плотностью r = 0,985 г/мл необходимо взять для приготовления 100 мл нашатырного спирта (w(NH3) = 10% и r = 0,957 г/мл).
Запишем два уравнения материального баланса на основе двух составных частей смеси:
|
|
|
| I | II | Смесь |
| NH3 (газ) | Раствор аммиака w(NH3) = 3%, r = 0,985 г/мл | 100 мл нашатырного спирта w(NH3) = 10%, r = 0,957 г/мл, |
а) по общей массе смеси
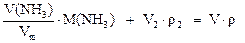 или
или
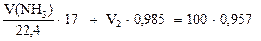 (*)
(*)
б) по массе аммиака
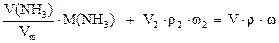 или
или
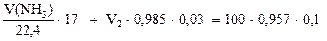 (**)
(**)
Решая систему из двух уравнений (*) и (**), находим необходимые объемы 3%-го раствора аммиака V2 = 90,15 мл и газообразного аммиака V(NH3) = 9,1 л
Пример 3. Приготовить 1 л раствора серной кислоты H2SO4 для автомобильных аккумуляторов (w(H2SO4)=30%, r=1,22г/мл) из концентрированного раствора (w(H2SO4)=95%, r=1,83г/мл).
Запишем два уравнения материального баланса на основе двух составных частей смеси:
| I | II | Смесь |
| Н2О r=1,0 г/мл | Раствор H2SO4 w(H2SO4)=95%, r=1,83г/мл | 1 литр раствора H2SO4 w(H2SO4)=30%, r=1,22г/мл 1 литр |
а) по общей массе смеси:
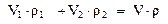 или
или
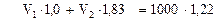 (*)
(*)
б) по массе серной кислоты:
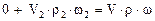 или
или
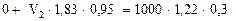 (**)
(**)
Решая систему из двух уравнений (*) и (**), находим объемы воды V1 = 834,8мл и концентрированного раствора серной кислоты V2 = 210,5 мл, необходимые для приготовления 1 л аккумуляторного раствора.
Заметим, что их суммарный объем 210,5 + 834,8 = 1045,3 мл больше одного литра. Это связано с тем, что при смешении происходит усадка раствора, обусловленная интенсивным экзотермический процессом гидратации молекул серной кислоты, о чем свидетельствует сильное разогревание смеси. Данный пример есть иллюстрация того факта, что объем смеси не всегда равен сумме объемов смешиваемых растворов.
Если химические реакции протекают в растворах, то расчеты по их уравнениям осложняются тем, что количества реагирующих веществ обычно задают через концентрации растворов. В этих случаях важно безукоризненно знать формулировку каждого способа выражения концентрации раствора, а также формулы связи между концентрациями и количеством растворенного вещества и его массой. Кроме того, следует обратить внимание на правильное определение качественного и количественного состава раствора после окончания химической реакции, а также правильное вычисление его массы:
1) Количества продуктов реакции определяет исходное вещество, взятое в недостатке, а исходное вещество, взятое в избытке, всегда присутствует в конечной смеси веществ.
2) Масса конечной смеси равна сумме масс составляющих ее исходных растворов и чистых веществ, из которой необходимо вычесть массы всех газообразных и малорастворимых продуктов реакции, которые покидают раствор.
3) Объем конечной смеси приближенно равен сумме объемов исходных растворов, а при растворении твердых и газообразных веществ объем раствора считается равным объему растворителя. Для достаточно разбавленных растворов можно принять, что rр-р » r(Н2О) = 1 г/ мл.
Пример 4. Молярное соотношение сульфата алюминия и гидроксида натрия в смеси равно 1:7, а общее число атомов равно 6,02×1023. К этой смеси добавили 20 мл воды и энергично перемешали, часть смеси при этом не растворилась. Определить массу надосадочной жидкости.
Прежде всего определим состав смеси, обозначив
n(Al2(SO4)3) = x моль и n(NaOH) = y моль.
По условию задачи х/у = 1/7 или у = 7 × х.
Формульная частица сульфата алюминия состоит из 17 атомов, тогда в х моль его содержится 17× х моль атомов. Формульная частица гидроксида натрия состоит из 3 атомов и в у моль его содержится 3× у моль атомов. Общее число атомов всех видов в смеси равно постоянной Авогадро, что соответствует одному молю, тогда 17 × х + 3 × у = 1.
Решение системы уравнений: 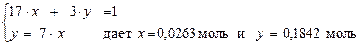
При добавлении к смеси воды протекает реакция ионного обмена:
Al2(SO4)3 + 6NaOH = 2Al(OH)3Ї + 2Na2SO4 (I)
Из двух исходных веществ опорным является Al2(SO4)3 – оно находится в недостатке (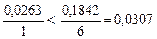 ). Составим расчетную схему:
). Составим расчетную схему:
Al2(SO4)3 + 6NaOH = 2Al(OH)3¯ + Na2SO4
| Начало реакции | 0,0263 моль | 0,1842 моль (избыт.) | ||
| Окончание реакции | 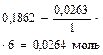
| 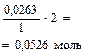
| 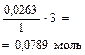
|
Остаток NaOH реагирует с осадком амфотерного основания Al(OH)3 c образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3Ї + NaOH = Na[Al(OH)4]
| Начало реакции | 0,0526 моль (избыток) | 0,0264 моль (недостаток) | |
| Окончание реакции | 0,0526 – –0,0264 = = 0,0262 моль | 0,0264 моль |
Таким образом, в результате двух реакций в осадке остается 0,0262 моля Al(OH)3Ї.
Определим массу надосадочной жидкости, которая является раствором Na2SO4 и Na[Al(OH)4]:
m раст. = m (H2O) + m (NaOH) + m (Al2(SO4)3) – m (Al(OH)3¯) =
= V(H2O) Ч1 г/мл + n(NaOH) Ч M(NaOH) +
+ n(Al2(SO4)3) × M(Al2(SO4)3) – n(Al(OH)3¯) Ч M(Al(OH)3 =
= 20 × 1 + 40 Ч 0,1842 +342 Ч 0,0263 – 78 Ч 0,0262 = 34,32 г.
 2015-04-30
2015-04-30 2739
2739








