Различают амперометрическое титрование с одним и двумя индикаторными электродами. В первом случае в качестве индикаторного используют ртутный капельный или вращающийся платиновый электрод. Электродом сравнения может служить водородный, меркуриодидный, каломельный, меркул-сульфатный или хлор-серебряный электрод. При амперометрическом титровании с двумя индикаторными электродами вместо электрода сравнения используют электрод, который помещают в титруемый раствор. Амперометрическое титрование позволяет выявить 10-6 г вещества в титруемом объёме.
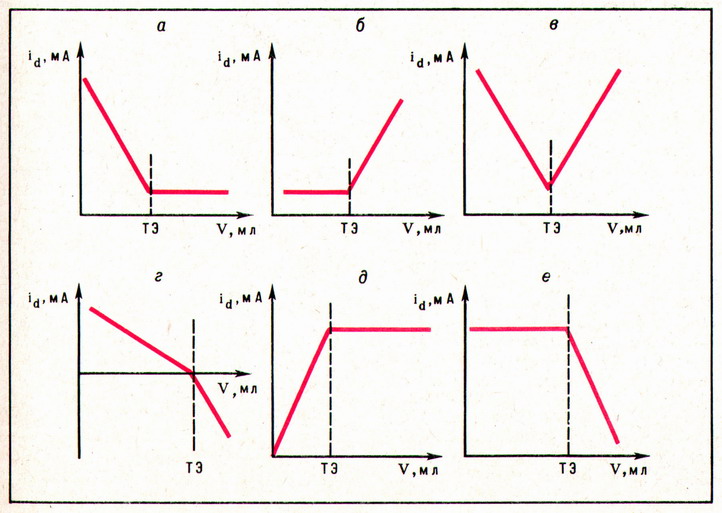
На рис. 2 кривая а соответствует титрованию электрохимически активного вещества раствором неактивного реагента (например, титрование Zn2+, Cd2+, Ni2+ и другим комплексоном III); кривая б — противоположный случай: титрование Mg2+ 8-оксихинолином.Кривая в построена для случая, когда исследуемое вещество и титрант восстанавливаются на электроде (например, определение Fe3+ а-нитрозо-b-нафтолом). Если на электроде одно вещество восстанавливается, а второе окисляется, форма кривой соответствует г, если взаимодействуют электрохимически неактивное вещество и титрант с образованием электрохимически активного вещества, то получают кривую д (например, титрование арсенатов иодидом калия, при взаимодействии которых образуется электрохимически активный I2). Кривая е соответствует случаю титрования с индикаторами (например, титрование щёлочи кислотой с индикатором из смеси ионов I- и IO3-, приводящее также к образованию электрохимически активного I2).
Кулонометрические методы.
Кулонометрия. в основе лежит процесс электролиза при котором, на поверхности электрода, опущенного в анализируемый раствор, под действием электр.тока происходит окисление или восстановление определяемого вещества.
Законы Фарадея. m = QM/nF
1.масса вещества, образующегося, при электролизе, прямо пропорциональна количеству электричества, прошедшего через электролит.
2. при электролизе различных химических соединений равные количества электричества вызывают электрохимич.превращение одинаковых количеств молей эквивалентов различных веществ.
Прямая кулонометрия – электрохимич.превращению подвергается анализируемое вещество.
В кулонометрическом титровании – не зависимо от электрохимич. активности определяемого вещества в испытуемый раствор вводят электрохимич.активный вспомогательный реагент, продукт электрохимического превращения которого, количественно взаимодействует с определяемым веществом. Кулонометрическое титрование отличается от прямой кулонометрии тем, что титрант образуется в электролитической ячейке из добавленного в нее вещества. Кулонометрическое титрование основано на том, через анализируемый раствор пропускают постоянный ток до тех пор, пока индикатор не укажет на завершении реакции.
Перенапряжение на электроде - характеризует влияние на величину потенциала природы электрода, состояние его поверхности и условий проведения электролиза (плотность тока, температура)
 2015-05-10
2015-05-10 6341
6341
