Автоматическое титрование
1. По способу введения титрующего вещества:
– объемное
– кулонометрическое (с внутренним и внешним генерированием титранта)
2. По типу химической реакции:
– нейтрализация
– ОВР
– реакции комплексообразования
3. По типу индикаторного концентратомера:
– потенциометрическое
– амперометрическое
– абсорбционное спектрофотометрическое
– кондуктометрическое
4. По степени автоматизации:
– ручное
– полуавтоматическое
– автоматическое
5. По способу автоматизации процесса
– дискретное
– непрерывное
Слайд 1
Характеристика методов титрования
Титрованием называют один из методов количественного анализа, целью которого является определение концентрации вещества известной природы А, находящегося в смеси с другими компонентами.
Для этого подбирают специальный реагент В, который избирательно реагирует с определяемым компонентом анализируемой смеси по схеме
А+В → С+D (1)
где С и D – продукты реакции титрования.
|
|
|
Раствор (реагент В), с помощью которого производится титрование называется титрующим веществом или титрантом.
Техника проведения титрования заключается в следующем: к известному объему анализируемой смеси, называемому пробой, постепенно добавляется титрант до тех пор, пока количества веществ А и В полностью не прореагируют, т.е. пока они не достигнут эквивалентного соотношения (в соответствии со стехиометрическим уравнение реакции).
Для проведения реакции необходимо брать такие объемы растворов, которые содержали бы одинаковое число грамм эквивалентов растворенных веществ. Растворы, характеризующиеся числом грамм эквивалентов растворенного вещества в 1 литре раствора носят название нормальных растворов.
Слайд 2
Пример:
Реакция нейтрализации: 2NaOH+H2SO4→Na2SO4+2H2O
50мл 20мл
х 0,1N
Определить концентрацию водного раствора едкого натрия, если в качестве титранта используется дицинормальная серная кислота.
Объем пробы NaOH: Vпр = 50мл
Объем титранта, затраченного на титрование: Vт = 50мл [0,1N H2SO4 ]
Ст = 0,1N H2SO4 = 0,1 (г*экв)/л = (98/2)*0,1 = 4,9 г/л H2SO4
Количество грамм эквивалентов вещества в пробе:
Qпр(экв.) = Vпр *Спр
Количество грамм эквивалентов вещества в титрующем растворе:
Qт(экв.) = Vт *Ст
Отсюда:
Vпр *Спр =Vт *Ст
Слайд 3
Момент, когда вещества полностью прореагируют в эквивалентных соотношениях называются точкой эквивалентности или конечной точкой титрования.
Концентрация определяемого компонента:
СА = К* СВ*(Vт/V) (2)
где К – постоянная, учитывающая стехиометрические коэффициенты при А и В в уравнении (1)
V – объем пробы
Vт – объем титранта
СВ – концентрация титранта
|
|
|
СА – концентрация определяемого компонента
При необратимой реакции титрования концентрация титруемого вещества a(t) изменяясь от СА в начале титрования до 0 в конечной точке, характеризует степень приближения к эквивалентной точке, а степень перотитрования характеризуется концентрацией в(t) титранта, изменяясь от 0 до СВ (теоретически).
Таким образом контролировать ход реакции титрования можно по изменению концентрации a(t) от начала процесса до конечной точки.
Слайд 4
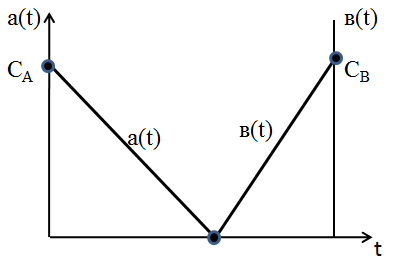
При необратимой реакции титрования концентрация титруемого вещества a(t) изменяясь от СА в начале титрования до 0 в конечной точке, характеризует степень приближения к эквивалентной точке, а степень перотитрования характеризуется концентрацией в(t) титранта, изменяясь от 0 до СВ (теоретически).
Таким образом контролировать ход реакции титрования можно по изменению концентрации a(t) от начала процесса до конечной точки.
Слайд 5
 2015-06-28
2015-06-28 980
980








