Простейшим объектом исследований молекулярной физики является идеальный газ.
Идеальный газ – это модель реального газа, обладающего следующими свойствами:
- собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
- между молекулами отсутствуют силы взаимодействия;
- столкновения молекул газа между собой и со стенками сосуда являются абсолютно упругими.
Количество вещества, обозначаемое ν, в системе СИ измеряется в молях: 1 моль - такое количество вещества, в котором содержится столько же атомов или молекул, сколько в 12 г чистого изотопа углерода 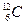 . Моль – основная единица системы СИ. Один моль разных веществ содержит одно и то же число молекул NA = 6,02 х 1023, называемое числом Авогадро. Масса одного моля вещества М, называемая молярной массой, равна
. Моль – основная единица системы СИ. Один моль разных веществ содержит одно и то же число молекул NA = 6,02 х 1023, называемое числом Авогадро. Масса одного моля вещества М, называемая молярной массой, равна
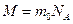 , (2.1)
, (2.1)
где m0 – масса молекулы.
Число молекул в произвольной массе вещества определяется выражением:
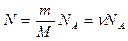 , (2.2)
, (2.2)
где m – масса газа, ν – количества вещества.
Состояние некоторой массы газа m определяется параметрами состояния, к которым относятся давление p, объем V, температура T. На основании обобщения эксперимен- тальных данных было получено соотношение, связывающее основные макроскопические параметры состояния газа:
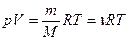 , (2.3)
, (2.3)
где 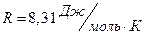 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Это уравнение называется уравнением состояния идеального газа или уравнением Менделеева - Клапейрона.
Введя новую фундаментальную постоянную 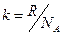 , называемую постоянной Больцмана, получим еще одну форму записи уравнения состояния
, называемую постоянной Больцмана, получим еще одну форму записи уравнения состояния
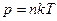 , (2.4)
, (2.4)
где 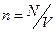 - концентрация молекул.
- концентрация молекул.
Это уравнение показывает, что при одинаковых значе- ниях температуры и давлении все газы содержат в единице объема одинаковое число молекул, а моли любых газов занимают одинаковые объемы (закон Авогадро).
Давление смеси идеальных газов подчиняется закону Дальтона, в соответствии с которым это давление равно сумме парциальных давлений, входящих в нее газов
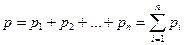 , (2.5)
, (2.5)
Парциальное давление это давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал этот объем при той же температуре.
 2015-05-14
2015-05-14 15208
15208
