Дано:
Металл – Zn
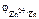 = –0,75 В = –0,75 В
| Решение
Электродный потенциал цинка рассчитываем по уравнению Нернста:
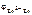 = = 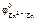 + + 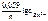 . .
|
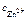 –? –?
|
Откуда:
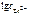 =
= 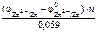
По табл. 11.1 определяем стандартный электродный потенциал цинка:
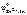 = 0,76 В, n – равно заряду иона цинка Zn2+ (n = 2).
= 0,76 В, n – равно заряду иона цинка Zn2+ (n = 2).
Тогда
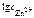 =
= 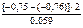 = 0,338.
= 0,338.
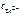 = 100,339 моль/л = 2,18 моль/л
= 100,339 моль/л = 2,18 моль/л
Ответ: 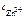 = 2,18 моль/л.
= 2,18 моль/л.
Составить две схемы гальванических элементов (ГЭ), в одной из которых олово служило бы анодом, в другой – катодом. Для одной из них написать уравнения электродных процессов и суммарной токообразующей реакции. Вычислить значение стандартного напряжения ГЭ.
Решение
В гальваническом элементе анодом является более активный металл с меньшим алгебраическим значением электродного потенциала, катодом – менее активный металл с большим алгебраическим значением электродного потенциала.
По табл. 11.1 находим 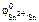 = –0,14 В.
= –0,14 В.
 2015-05-10
2015-05-10 1304
1304








