Состояние данной массы полностью определено, если известны давление, температура и объем газа. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа единичное состояние газа описывается уравнением Менделеева— Клапейрона: pV = mRT/M, где р — давление, V —
объем, т — масса, М — молярная масса, R — универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 Дж/моль • К).
Уравнение Менделеева—Клапейрона показывает, что возможно одновременно изменение пяти параметров, характеризующих состояние идеального
газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра из пяти. Особую роль в физике и технике играют три процесса: изотермический, изохорический и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля-Мариотта. pV = const.
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля. V = const. p/T = const.
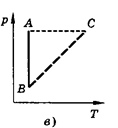
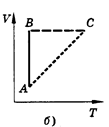
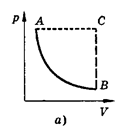 Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T == const при р = const и называется законом Гей-Люссака. Все процессы можно изобразить графически (рис. 11).
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T == const при р = const и называется законом Гей-Люссака. Все процессы можно изобразить графически (рис. 11).
Рис.11
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
 2015-05-20
2015-05-20 1038
1038








