Рассмотрим кислую соль слабой двухосновной кислоты МНА. В растворе такая соль практически полностью диссоциирует на М+ и НА-. Анион НА- может диссоциировать дальше.
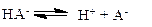
| (1.78) |
С другой стороны, он может присоединить ион водорода (с образованием недиссоциированных молекул кислоты).

| (1.79) |
В соответствии с этими реакциями концентрация водородных ионов может быть выражена следующим образом:
| [H+] = [A2-] -[H2A] | (1.80) |
Концентрации А2- и Н2А можно найти из выражений для констант диссоциации Н2А
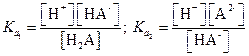
|
Концентрация НА- в первом приближении может быть принята равной общей концентрации соли H2A.
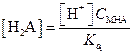
| (1.81) |
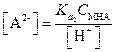
| (1.82) |
Подставим полученные значения в уравнение (1.80)
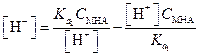
| (1.83) |
Решая уравнение (1.83) относительно [Н+], получим
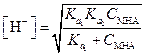
| (1.84) |
Если С МНА значительно больше 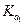 (
(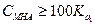 ), уравнение упрощается
), уравнение упрощается
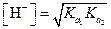
| (1.85) |
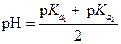
| (1.86) |
Аналогичные уравнения применимы и для вычисления рН растворов кислых солей многоосновных кислот, если константы диссоциации их значительно различаются между собой.
Пример 19. К 50 мл 0.1 М раствора Na2CO3 добавлено 25 мл 0.2 М раствора НС1. Вычислить рН раствора.
|
|
|
Решение. Напишем уравнение реакции
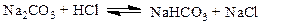
|
Концентрация Na2CO3 в исходном растворе равна 50×0.1 = 5 мМ, С НС1 = 25×0.2 = 5 мМ. Следовательно, в растворе образовалась кислая соль NaHCO3, ее концентрация значительно превышает 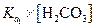 . Расчет рН можно провести по уравнению (1.86)
. Расчет рН можно провести по уравнению (1.86)
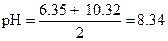
|
Пример 20. К 20 мл 0.15 М раствора Na3PO4 добавлено 10 мл 0.3 М НС1. Вычислить рН раствора.
Решение. Начальные концентрации Na3PO4 и НС1 равны между собой (20×0.15 = 3 мМ; 10×0.3 = 3 мМ). Таким образом, в растворе присутствуют только Na2HPO4 и NaCl. Соль Na2HPO4 можно рассматривать как кислую соль двухосновной кислоты Н2РО4-.
Для вычисления рН применим формулу (1.86)
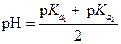
|
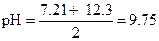
|
 2015-05-13
2015-05-13 2629
2629








