Материалы могут находиться в различных фазовых, агрегатных и физических состояниях. Фазовые (термодинамические) состояния (твёрдое, жидкое и газообразное) отличаются друг от друга структурой. Агрегатные состояния (твёрдое, жидкое и газообразное) отличаются по критерию формы. Вещества в твёрдом агрегатном состоянии имеют свою форму, в жидком агрегатном состоянии имеют форму сосуда, в которой находится эта жидкость, или форму капли. В газообразном состоянии вещество занимает весь доступный ему объём. Физические состояния характеризуют поведение материалов, находящихся под нагрузкой, в зависимости от температуры. Это стеклообразное и вязкотекучее состояния. Полимеры имеют ещё одно физическое состояние – высокоэластическое.
Переход из одного фазового состояния в другое сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других физических свойств. Существует ещё одно состояние, называемое плазмой, представляющее собой сильно ионизированный газ, т.е. газ заряженных частиц – ионов, электронов. Это состояние возникает при температурах свыше 105 К. Однако, между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющемся на больших расстояниях.
|
|
|
Одно и то же твёрдое вещество в зависимости от условий затвердевания может быть в кристаллическом или в аморфном состоянии. Для твёрдого вещества обычным является кристаллическое состояние – это состояние почти полной упорядоченности материальных частиц – атомов, ионов или молекул, из которых состоит вещество. Упорядоченность расположения этих частиц в значительных объёмах вещества обозначают термином «дальний порядок». Под этим термином понимают закономерную повторяемость расположения частиц в любом направлении относительно выбранной частицы. В аморфных веществах дальнего порядка нет, – там существует «ближний порядок». Под этим термином подразумевается, что с определённой долей вероятности можно судить о среднем количестве частиц в ближайшем окружении интересующей нас частицы. В газообразном состоянии вещество полностью неупорядоченно.
Вещество в кристаллическом состоянии может находиться в виде собственно кристаллов, например, NaС1, алмаз, или в виде поликристаллических агрегатов (мрамор, большинство металлов). Кристаллическое состояние, в отличии от аморфного, характеризуется определённой температурой плавления Тпл, часто – геометрической формой, во многих случаях – анизотропией свойств.


 Обычно из более простых и симметричных частиц получаются более простые и симметричные кристаллические постройки. Так, шарообразные частицы, например, атомы или одноатомные ионы, образуют кристаллические структуры, которые почти буквально повторяют наиболее плотные упаковки подшипниковых шариков или мячей настольного тенниса – по гексагональному закону.
Обычно из более простых и симметричных частиц получаются более простые и симметричные кристаллические постройки. Так, шарообразные частицы, например, атомы или одноатомные ионы, образуют кристаллические структуры, которые почти буквально повторяют наиболее плотные упаковки подшипниковых шариков или мячей настольного тенниса – по гексагональному закону.
|
|
|







Рис. 1. Плотнейшая упаковка шаров в одном слое..
В зависимости от того, как будут укладываться такие последующие слои шаров относительно предыдущих, могут образовываться как «гексагональная плотнейшая упаковка», так и «кубическая плотнейшая упаковка».
Чтобы установить тип упаковки, нужно определить тип симметрии данного атомного расположения и выделить соответствующую структурную единицу. Сначала остановимся на структурной единице. Всякий повторяющийся узор можно разделить на множество «мотивных единиц», совершенно одинаковых, соприкасающихся друг с другом без промежутков (смотри рис. 2). Следовательно, в принципе выбор мотивной единицы произволен. Обычно наиболее удобно считать единицей узора – структурной единицей параллелограмм с кратчайшими сторонами и с углами, наиболее близкими к прямым.
По тем же принципам анализируются пространственные узоры, которые всегда можно разделить на единицы в форме ящиков, называемых «элементарными ячейками» (смотри рис. 3).

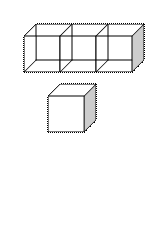
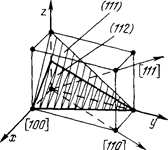
Рис.2. Плоский узор. Рис.3. Пространственный узор, элементарная ячейка и индексы направлений и плоскостей.
Элементарная ячейка полностью определена тогда, когда известны:
1) все три ребра повторяющегося параллелепипеда;
2) углы, которые образуют между собой три ребра ячейки;
3) тип, число и положение структурных единиц (атомов, ионов, молекул), из которых состоит ячейка.
Число частиц, окружающих данную частицу, называется «координационным числом» (к.ч.). К.ч. £ 12.
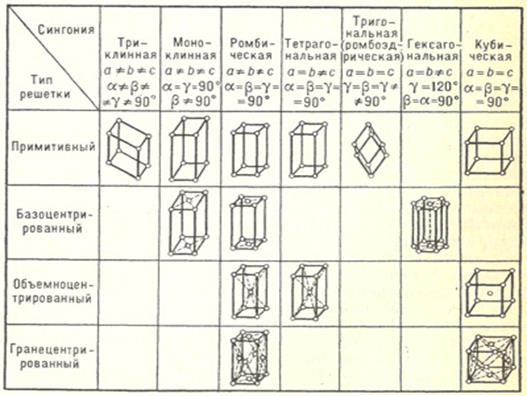
Всего известно 14 видов пространственных решёток, которые различаются между собой по симметрии и формам элементарных ячеек. Эти 14 видов решёток геометрически вывел в 1848 г французский кристаллограф Огюст Браве. 14 решёток Браве подразделяются на 4 типа, в которых можно различить семь сингоний (сходноугольность в примерном переводе с греческого).
1) примитивные – имеют узлы (т.е. материальные частицы – атомы, ионы, молекулы) в вершинах ячейки.
2) базоцентрированные – узлы находятся в вершинах и в центрах двух противоположных гранях;
3) объёмноцентрированные – узлы находятся в вершинах и в центре ячейки;
4) гранецентрированные – узлы находятся в вершинах и в центре каждой грани.
В примитивных решётках на одну элементарную ячейку приходится всего одна частица. Может показаться, что примитивная элементарная ячейка содержит 8 частиц, которые находятся в узлах ячейки. В действительности каждая частица, находящаяся в узле ячейки, принадлежит восьми ячейкам, а данной ячейке принадлежит 1/8 этой частицы.
Таблица 1.
В базоцентрированных решётках на одну ячейку приходится 2 частицы: 8 восьмушек (8 х 1/8) и две половинки. Столько же частиц приходится на одну ячейку в объёмноцентрированных решётках.
Больше всего частиц в одной ячейке приходится в гранецентрированных решётках – четыре. 8 х 1/8 и 6 половинок в каждой из шести граней.
Практически все металлы (78%) кристаллизуются в трёх типах решёток: объёмноцентрированной кубической (ОЦК), гранецентрированной кубической (ГЦК) и гексагональной плотноупакованной (ГП).
Плотность упаковки ячеек возрастает от 1-го к 4-му типу. Плотность упаковки – это отношение объёма, занятого атомами, к общему объёму элементарной ячейки. Когда в кристаллической решётке (элементарной ячейке) в узлах помещают шарики, надо иметь в виду, что они изображают не частицы (атомы), а центры тяжести этих атомов. Атомы же упруго соприкасаются друг с другом, как показано на рис. 4.
|
|
|
Русский учёный Е.С. Фёдоров показал, что 14 элементарных решёток в кристаллических многогранниках могут совмещаться (взаимное проникновение), образуя 230 возможных комбинаций или пространственных групп.
Способ упаковки материальных частиц или, иначе, вид элементарной ячейки, определяет форму кристаллов.
Рис.4. Объёмное изображение структуры гексагональной плотной упаковки.
Кристаллы ограничиваются плоскими гранями, пересекающимися на рёбрах, которые, в свою очередь, пересекаются в вершинах. Форма кристаллов весьма разнообразна, но симметрична. В кристаллах различают следующие элементы симметрии:
1) плоскость симметрии – воображаемая плоскость, делящая кристалл на 2 части, являющимися зеркальными отражениями друг друга;
2) ось симметрии – линия, при вращении вокруг которой кристалл некоторое число раз совмещается сам с собой. Это число определяет порядок оси. Доказано, что в кристаллах возможны оси симметрии только 2, 3, 4 и 6 порядков;
3) центр симметрии – точка внутри кристалла, в которой пересекаются и делятся пополам линии, соединяющие соответственные точки на поверхности кристалла.
В кристаллах элементы симметрии могут встречаться как поодиночке, так и в сочетании друг с другом. Полная совокупность элементов симметрии многогранника называется видом симметрии. Русский академик А.В.Гадолин в 1867 г. доказал, что возможны 32 вида симметрии, которые сгруппированы в 7 кристаллографических систем или сингоний. Характеристики этих сингоний (углы между гранями и длина осей) приведены в таблице 1.
У различных веществ, принадлежащих к одной сингонии, углы между гранями иногда могут несколько отличаться, но у всех кристаллов данного вещества одной кристаллической формы углы между гранями постоянны. Это установили Стено в 1669 г. и Роме де Лиль в 1772 году.
В природе встречаются вещества, кристаллизующиеся одинаковым образом в одной кристаллической системе. Такие вещества называют изоморфными. Обнаружилось, что изоморфные вещества в ряде случаев способны кристаллизоваться совместно с образованием смешанныхкристаллов переменного состава. Точные измерения показали, что кристаллы изоморфных веществ не всегда строго одинаковы по форме, а только относительно близки. Так
|
|
|
ZnCO3 MgCO3 FeCO3 MnCO3 CdCO3 CaCO3 кристаллизуются в тригональной сингонии в форме ромбоэдров, однако характерные углы ромбоэдра a для них несколько различны:
103028’ 103021’ 103004’ 102050’ 102030’ 101055’
Не все вещества с одинаковой кристаллографической формой и химически сходные между собой способны образовывать смешанные кристаллы. Для этого необходимо, чтобы радиусы соответствующих атомов или ионов, т.е. тех, которые замещают друг друга в кристаллической решётке, не отличались друг от друга более чем на 15%. Если в узлах кристаллической решётки находятся молекулы, имеющие сложную форму, то требование подобия размеров становятся более жёсткими. А для полимерных кристаллов различия в поперечниках макромолекул должны быть менее 1%, поэтому образование смешанных полимерных кристаллов – очень редкое явление. Способность образовывать твёрдые растворы свойственна всем кристаллическим твёрдым телам. В большинстве случаев она ограничена узкими пределами концентраций (так называемые ограниченные твёрдые растворы), но известны системы с непрерывным рядом твёрдых растворо, например, системы Cu – Au, Ti – Zr, GaAs - GaP. По существу, все кристаллические вещества, считающиеся чистыми, представляют собой твёрдые растворы с очень малым содержанием примесей.

 Смешанные кристаллы чаще называют «изоморфно-замещённымикристаллами» или «твёрдыми растворами замещения» или «фазами переменного состава». Последний термин более общий, он включает в себя и другие структуры, например, твёрдые растворы внедрения, дефицитные структуры, т.е. такие, у которых в некоторых элементарных ячейках отсутствуют некоторые элемент, например, WS2,12, FeS. Термин «твёрдые растворы» подчёркивает аналогию с распределением одного компонента в другом, наблюдаемую в обычных растворах, а именно, - в среднем равномерное, но случайное распределение компонентов. Состояние таких систем описывается «фазовой диаграммой». Если компоненты смешиваются друг с другом неограниченно, то диаграмма состояния имеет вид, представленные на рис. 5.
Смешанные кристаллы чаще называют «изоморфно-замещённымикристаллами» или «твёрдыми растворами замещения» или «фазами переменного состава». Последний термин более общий, он включает в себя и другие структуры, например, твёрдые растворы внедрения, дефицитные структуры, т.е. такие, у которых в некоторых элементарных ячейках отсутствуют некоторые элемент, например, WS2,12, FeS. Термин «твёрдые растворы» подчёркивает аналогию с распределением одного компонента в другом, наблюдаемую в обычных растворах, а именно, - в среднем равномерное, но случайное распределение компонентов. Состояние таких систем описывается «фазовой диаграммой». Если компоненты смешиваются друг с другом неограниченно, то диаграмма состояния имеет вид, представленные на рис. 5.
Для жидких систем верхняя кривая характеризует состав пара, а нижняя кривая – состав жидкости. Точно так же выглядит диаграмма состояния для твёрдого раствора замещения. В этом случае верхняя кривая называется линией ликвидуса, выше её система представляет собой жидкость (расплав). Нижняя линия называется линией солидуса, ниже этой линии система находится в твёрдом (кристаллическом) состоянии. В твёрдых растворах параметры кристаллических решёток изменяются пропорционально составу. Знание фазовой диаграммы для данной смеси веществ даёт возможность изготавливать твёрдые растворы заданного состава.
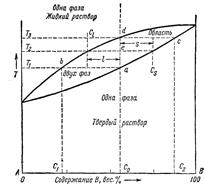
Рис. 2.5. Фазовая диаграмма системы с неограниченной взаимной растворимостью.
Другой разновидностью твёрдых растворов являются «твёрдые растворы внедрения». В этом случае в кристаллическую решётку (чаще всего металлическую) в междоузлия внедряются атомы неметалла. Очевидно, что это возможно тогда, когда в кристаллической решётке матричного вещества имеются «пустоты», а внедрённые атомы малы и их размеры соизмеримы с этой «пустотой». Понятно, что возможны только ограниченные твёрдые растворы. К атомам, которые могут располагаться в междоузлиях металлической решётки, относятся Н, С, N, O, B, Si. Присутствие внедрённых атомов вызывает напряжение в материнской решётке, искажение кристаллической решётки вплоть до изменения её симметрии, например, переход кубической симметрии в тетрагональную.
Кроме явления изоморфизма в кристаллических веществах проявляется полиморфизм.Явление полиморфизма состоит в том, что в зависимости от условий (температуры, давления) одно и то же вещество может образовывать разные по симметрии и форме кристаллы. Эти формы, называемые полиморфными разновидностями или модификациями, принято обозначать буквами a, b, g и т.д., причём a обычно относится к модификации, стабильной при наиболее низкой температуре. Различные кристаллические модификации одного и того же вещества могут по своим свойствам очень сильно отличаться. Примерами могут служить графит и алмаз, нитрид бора ВN с решёткой, подобной решётке графита и с кубической решёткой, подобной решётке алмаза (боразон в США и эльбор в СССР). Кубический нитрид бора обладает твёрдостью, соизмеримой с твёрдостью алмаза – он царапает некоторые грани алмаза.
Структуру кристаллов изучают рентгеновскими методами. Впервые для изучения кристаллов рентгеновские лучи (X-ray) использовал молодой доцент в Мюнхене М. Лауэ в 1912 году. Через год В.Г.Брэгг (впоследствии сэр Вильям) в Лидсе и его сын В.Л.Брэгг (впоследствии сэр Лоренс) в Кембридже видоизменили метод Лауэ – использовали рентгеновские лучи со строго определённой длиной волны l, при этом наблюдали дифракцию рентгеновских лучей. В.Л.Брэгг вывел уравнение, устанавливающее зависимость между углом дифракции a, длиной волны рентгеновских лучей l и расстоянием между последовательными атомными слоями d, которое с тех пор успешно применяется для определения параметров кристаллических решёток. Простота уравнения действительно совершенно исключительная: Sina = nl/2d, где n равно 1, 2, 3 или любому целому числу. Когда различие в пройденном пути луча 2 и луча 1 nA' + A'm равно nl - происходит интерференция и на фотографической пластинке появляется пятно. Зная l, можно определить d – межплоскостное расстояние и, следовательно, параметры кристаллической решётки.
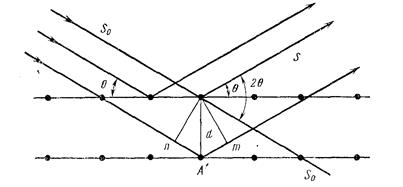
Рис.2.6. Схема отражения лучей от одномерной структуры с периодом d (So — падающие лучи, S — дифрагированные; разность хода между лучами, отраженными от двух плоскостей, равная пА' + тА' = 2d sinθ; угол между падающим и дифрагированным лучом равен 2θ).
Все эти соображения о структуре кристаллов совершенно справедливы для подавляющего числа известных кристаллических веществ. Однако некоторые утверждения, в частности, что возможны только оси симметрии 2, 3, 4 и 6 порядков, в последнее время пришлось пересмотреть. Это связано с открытием кристаллических образований, имеющих оси симметрии 5, 8 и 12 - того порядков. В 1982 году израильтянин Даниель Шехтман при исследовании быстро закалённого сплава Al-Mn впервые получил микродифракционную картинку (дифракция электронов), имеющую симметрию пятого порядка, т.е. она совмещалась сама с собой при повороте на 1/5 окружности. Казалось, этого не могло быть, т.к. пространство невозможно плотно заполнить фигурами на основе пятиугольников. И, тем не менее, в расположении плоскостей решётки наблюдался хороший дальний порядок.
В 1984 году Даниелю Шехтману с коллегами удалось опубликовать первую, основополагающую статью, после чего многие учёные – материаловеды принялись изучать подобные структуры, которые получили название «квазикристаллы».

Рис. 2.7. Слева дифрактограмма от квазикристалла системы Al-Pd-Mn вдоль оси симметрии пятого порядка, справа – привычная дифрактограмма от кристалла с разрешённой симметрией шестого порядка.
Это открытие, как сказано в материалах Нобелевского комитета, вызвало настоящее смятение умов. В 2011 году Шехтман за открытие квазикристаллов получил Нобелевскую премию по химии. Теперь для признания кристаллической структуры вещества достаточно хорошей дифракции рентгеновскихлучей. Правильного строения с трансляционной симметрией больше не требуется.
В зависимости от природы частиц, образующих кристалл, различают 4 основных типа кристаллических структур: атомные, молекулярные, ионные и металлические.
В кристаллах с атомной структурой в узлах решётки находятся атомы, между которыми действуют ковалентные связи. Такие кристаллы обладают высокой температурой плавления Тпл, большой твёрдостью. Примером могут служить алмаз, карбид кремния.
В кристаллах с молекулярной структурой в узлах решётки находятся полярные или неполярные молекулы, между которыми действуют межмолекулярные силы. Такие структуры имеют низкие Тпл, невысокую твёрдость. Примером могут служить кристаллы СО2 (сухой лёд), парафин, полиэтилен.
Кристаллы с ионной структурой имеют высокие Тпл и Ткип. Примеры – NaCl, CaCO3.
Особое место занимает металлическая структура. Металлическая связь по своей природе близка к ковалентной, но, в отличие от обычной ковалентной, образуется делокализованными, т.е. не имеющими постоянного места, электронами, не имеет постоянного направления. По этой причине металлы обладают металлическим блеском, электропроводностью, теплопроводностью и ковкостью.
Реальные кристаллы отличаются от идеальных тем, что они несовершенны, они имеют дефекты – частичное нарушение порядка расположения материальных частиц. Простейшим видом дефектов являются тепловые колебания составных частей решётки. Средняя амплитуда атомных колебаний µ Ö`Т. Легко подсчитать, что при нагревании от комнатной температуры (300 К) до Тпл многих элементарных кристаллов (1200 – 1900 К) амплитуда колебаний увеличивается в 2 – 2,5 раза. При 300 К амплитуда @ 0,2 Ао, следовательно, при Тпл амплитуда составляет @ 0,5 Ао. Как видим, тепловые колебания атомов даже в состоянии «предплавления» на порядок меньше межатомных расстояний = nАо. Таким образом, переход кристалла к расплаву не означает полного уничтожения порядка.
Истинная энергия каждого атома не равна средней энергии. В кристалле существуют атомы, энергия которых настолько велика, что они способны покинуть регулярные позиции в узлах решётки и перейти в промежуточное положение, называемое междоузлиями. Образовавшийся в результате этого незанятый узел называется вакансией, а атом, попавший в междоузлие – внедрённым атомом. Вакансии и внедрённые атомы – это простейшие виды точечных дефектов в кристаллах, они носят название «дефекты по Френкелю».
Вакансий в кристаллах очень мало – даже при Тпл их одна на 1000 регулярно расположенных атомов.
Существует другой механизм образования вакансий, энергетически более выгодный. Суть его заключается в том, что тепловые колебания атомов поверхности кристалла выбрасывают атом на поверхность. Образовавшееся пустое место занимается атомом из более глубокого слоя, на месте которого и образуется вакансия. Образовавшаяся вакансия за счёт обмена местами с атомами узлов перемещается в глубь кристалла. Вакансии, образовавшиеся по этому механизму, называются «дефектами по Шотки». Сюда вставить о роли точечных дефектов в диффузии нужных атомов в кристаллы.
Помимо того, что точечные дефекты влияют на свойства материалов – теплопроводность, электрические и диэлектрические свойства, магнитные, оптические, механические и др., эти дефекты нужны кристаллу для его устойчивости. Различного рода дефекты - это тот беспорядок, который порядку необходим, он в некоторой степени компенсирует уменьшение DS при кристаллизации. Другие виды дефектов – это трещины, поры и дислокации. Дислокации – это линейные (а не точечные) дефекты кристаллической решётки, нарушающие правильное чередование атомных плоскостей и образующих внутри кристалла зону сдвига. В простых решётках существует два вида дислокаций – краевые и винтовые. Во многом образование их связано с механизмом кристаллизации
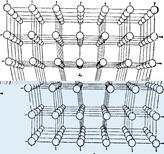
Рис.7. Расположение атомов, соответствующее краевой дислокации.
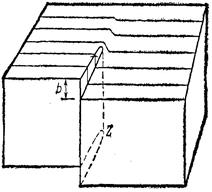
Рис.8. Структура кристалла с винтовой дислокацией.
2.1. Механизм кристаллизации.
Кристаллы образуются при охлаждении расплавов или насыщенных растворов и при испарении растворителя из растворов. Иногда кристаллы образуются непосредственно при охлаждении паров, минуя жидкую фазу (снег) или на холодных поверхностях (иней). Первой стадией процесса кристаллизации является образование мельчайших кристалликов – «зародышей кристаллизации». Это происходит при некотором переохлаждении расплава ниже Тпл или раствора ниже температуры насыщения.
Когда кристаллические зародыши уже появились, они начинают расти, непрерывно увеличиваясь в размерах. Частицам (атомам, ионам, молекулам) легче закрепиться на готовом кристалле, чем создавать новые зародыши.
Таким образом, кинетика кристаллизации складывается из двух величин – скорости образования зародышей и скорости роста кристаллов. Общим условием, необходимым для выделения кристаллов из раствора, расплава или пара является пересыщение или переохлаждение. Только полимерные кристаллы могут выращиваться из разбавленных растворов. Скорость образования кристаллической структуры пропорциональна скорости образования зародышей, а также скорости их последующего роста.
Образованию зародышей кристаллизации препятствует тепловое движение, которое может разбросать, разрушить случайно, по флуктуационному механизму сошедшиеся вместе частицы (атомы, ионы, молекулы). Необходимо, чтобы образующийся зародыш имел размеры, способные противостоять разрушающему действию тепла.Устойчивый зародыш или зародыш критического размера представляет собой кристалл, который по своим размерам находится в равновесии со средой, поэтому вероятность его роста и растворения (расплавления) одинакова.
Скорость образования зародышей максимальна при температурах значительно ниже Тпл. Линейная скорость роста кристаллов, напротив, имеет максимум немного ниже Тпл. Обычно Ткр = 8/9 Тпл. (рис.9).
При высокой температуре, близкой к Тпл, устойчивые зародыши имеют большие размеры, но их очень мало. В результате при изотермической кристаллизации вырастают крупные кристаллы. При низкой температуре появляется много мелких зародышей, – в результате образуется мелкокристаллическая структура.
 |
V 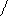
 образование зародышей
образование зародышей
 рост кристаллов
рост кристаллов
 |
tпл Т
Рис.9. Температурная зависимость скоростей образования зародышей и роста кристаллов.
Для металлов мелкокристаллическая структура предпочтительнее – ей отвечают лучшие механические свойства. В ряде случаев, наоборот, требуется крупнокристаллическая структура. Если же скорость охлаждения будет настолько велика, что не успеет произойти рост кристаллов (но зародыши кристаллизации могут возникнуть), материал останется аморфным. Для получения аморфных металлов скорость охлаждения должна быть порядка 106 оС/с. По этой причине аморфные металлы получаю только в виде тонких плёнок или нитей, когда можно обеспечить такую скорость охлаждения. Аморфные металлы и сплавы обладают высокой прочностью (1 – 5 ГПа), сверхвысокой коррозионной стойкостью (т.к. в них нет зёрен и, соответственно, нет границ зёрен) и порою высокой магнитной проницаемостью.
Знание кинетических закономерностей кристаллизации даёт возможность направленно изменять свойства материалов.
2.2. Термодинамика кристаллизации.
Мы познакомились с тем, как происходит кристаллизация. Попробуем разобраться в вопросе, почему происходит кристаллизация. Известно, что в природе самопроизвольно совершаются только те процессы, в результате которых уменьшается свободная энергия DF или энергия Гиббса DG. DG = DH - TDS
Возникновение и рост новой фазы относятся к тем явлениям, которые, строго говоря, невозможно описать методами классической термодинамики – они представляют термодинамический парадокс. Переход от переохлаждённой жидкости к кристаллу размером r** сопровождается повышением свободной энергии системы в целом. Появление зародыша размером r* (r* = 10 – 100Ао) необъяснимо термодинамически и происходит как флуктуационное явление.
Дальнейший рост кристалла сопровождается уменьшением энтальпии DН за счёт уменьшения свободной поверхности кристалла и образования связей между частицами (химических, электростатических, межмолекулярных). Одновременно уменьшается энтропия, что должно препятствовать образованию кристалла (степень беспорядка уменьшается).
 |
DG
 |
 0
0
r* r** r
 Рис.10. Изменение D G в процессе роста зародыша кристаллизации.
Рис.10. Изменение D G в процессе роста зародыша кристаллизации.
Для того, чтобы уменьшение энтропии не было настолько значительным, чтобы запретить рост кристалла, в кристалле образуются дефекты. В зависимости от конкретных условий формирующийся кристалл самопроизвольно приобретает тот вид дефектов, который при наименьших энергетических затратах обеспечивает максимальное увеличение энтропии по сравнению с идеальным кристаллом, где S = 0.
При повышении температуры порядок в расположении частиц нарушается, энтропия растёт и при ТDS > DH значение DG < 0, что соответствует самопроизвольному процессу плавления. При ТDS = DH значение DG = 0, что соответствует состоянию равновесия между кристаллом и расплавом. Отсюда Тпл = DН /DS.
Таким образом, идеальные кристаллы не только возникают с малой вероятностью, но и не имеют возможности роста при малых пересыщениях (переохлаждениях). Возможно, этим и объясняется широкая распространённость кристаллов с дислокациями – только не идеально построенные зародыши новой фазы растут с достаточно большими скоростями. Но вообще, наблюдаемая относительно высокая скорость возникновения зародышей новой фазы – это одна из нерешённых проблем современной термодинамики.
2.3. Правило фаз Гиббса, фазовые диаграммы.
Нелишне вспомнить некоторые известные из предыдущих курсов понятия.
 Фазой называют совокупность всех гомогенных частей системы, одинаковых во всех точках по составу и по всем химическим и физическим свойствам (не зависящим от количества) и отграниченных от других частей некоторой видимой поверхностью (поверхностью раздела). Так, например, в системе, состоящей из льда, воды и пара, все куски льда образуют одну фазу, вода – другую, а пар – третью. Здесь одно вещество – вода образует 3 фазы.
Фазой называют совокупность всех гомогенных частей системы, одинаковых во всех точках по составу и по всем химическим и физическим свойствам (не зависящим от количества) и отграниченных от других частей некоторой видимой поверхностью (поверхностью раздела). Так, например, в системе, состоящей из льда, воды и пара, все куски льда образуют одну фазу, вода – другую, а пар – третью. Здесь одно вещество – вода образует 3 фазы.


 Поверхности раздела фаз образуются некоторым количеством молекул, расположенных на границе области, заполненной данной фазой. Молекулы, образующие поверхностный слой, находятся в особых условиях, вследствие чего обладает свойствами (например, избыточной поверхностной энергией), не присущими веществу, находящимися в глубине фазы. Образования, составленные из небольшого числа молекул, не могут быть разделены на поверхностный слой и внутреннюю массу вещества, поэтому к образованиям с очень малым объёмом понятие «фаза» неприложимо (вспомните зародыши кристаллизации).
Поверхности раздела фаз образуются некоторым количеством молекул, расположенных на границе области, заполненной данной фазой. Молекулы, образующие поверхностный слой, находятся в особых условиях, вследствие чего обладает свойствами (например, избыточной поверхностной энергией), не присущими веществу, находящимися в глубине фазы. Образования, составленные из небольшого числа молекул, не могут быть разделены на поверхностный слой и внутреннюю массу вещества, поэтому к образованиям с очень малым объёмом понятие «фаза» неприложимо (вспомните зародыши кристаллизации).
Каждое вещество, которое может быть выделено из системы и существовать вне её, называется составляющим веществом системы. Если в системе есть составляющие вещества, которые химически взаимодействуют друг с другом, образую другие вещества, то нет необходимости экспериментально определять концентрации всех составляющих веществ, т.к. состав фаз равновесной системы можно определить, зная концентрации лишь части составляющих веществ. Составляющие вещества, концентрации которых определяют состав фаз данной равновесной системы, называются независимыми составляющими веществами или компонентами системы.
Число компонентов или совпадает с числом составляющих веществ (при отсутствии химических реакций как в системе вода – лёд – пар) или меньше его. Число компонентов есть наименьшее число составляющих веществ, достаточное для определения состава любой фазы системы.
Между числом фаз (Ф) и числом компонентов (К) системы существует известное термодинамическое соотношение, которое называется «правилом фаз» Гиббса
С = К – Ф + n.
С – это число степеней свободы, т.е. число переменных, которым можно придавать произвольные значения при данном числе фаз, n – число внешних факторов (например, температура, давление, концентрация), влияющих на положение равновесия. Обычно n принимается равным двум – часто это температура и давление.

| 
|

| 
|
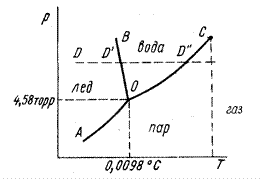
Рис. 11. Фазовая диаграмма однокомпонентной системы (вода).

На рис. 11 представлена фазовая диаграмма однокомпонентной системы – воды – в координатах давление пара – температура. Диаграмма разбита на три области, каждая из которых охватывает все возможные сочетания Т и Р, отвечающие равновесному существованию определённой фазы. Пограничные линии принадлежат обеим соприкасающимся областям. В областях диаграммы, где существует только какая-либо одна фаза, правило фаз разрешает системе иметь две степени свободы: С = 1 – 1 + 2 = 2. При наличии двух фаз, когда интересующее нас состояние определяется точкой на какой-либо кривой, система будет иметь одну степень свободы: С = 1 – 2 + 2 = 1. В точке О, где сходятся все три пограничные линии, возможно одновременное существование всех трёх фаз Не трудно подсчитать, что в этой точке (тройная точка) число степеней свободы равно нулю, т.е. ни температуру, ни давление изменять здесь нельзя: С = 1 – 3 + 2 = 0. Диаграмма показывает возможность непосредственного перехода газа в твёрдое тело и твёрдого тела в газ (сублимация).
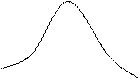
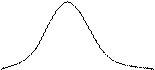
Существует ещё одно состояние – промежуточное между жидким и газообразным. Впервые оно было обнаружено Каньяр де ля Туром в 1822 г. При высоких температурах и давлениях, например, при нагревании жидкости в герметически закрытом сосуде, вследствие расширения жидкости её плотность будет уменьшаться, а плотности паров над её поверхностью будет возрастать и когда их плотности уравняются, исчезнет граница раздела. Д.И. Менделеев в 1861 г. установил, что для каждой жидкости существует область температур и давлений, при которых исчезает всякое различие между жидкостью и её паром. Такое состояние называют сверхкритическим, а вещества в сверхкритическом состоянии - сверхкритическими флюидами. Они обладают свойствами сверхрастворителей.
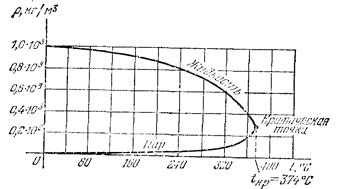
Рис. 12. График зависимости плотности воды и её насыщающего пара от температуры.
Это явление изучали Фарадей, Эндрюс, Ван-дер-Ваальс, Ландау. Техническое применение веществ в сверхкритическом состоянии, главным образом воды и СО2, началось в 70-х годах ХХ века.
Для системы из двух компонентов правило фаз даёт следующие значения степеней свободы:
С = 2 – 1 + 2 = 3 при Ф = 1
С = 2 – 2 + 2 = 2 при Ф = 2
С = 2 – 3 + 2 = 1 при Ф = 3
С = 2 – 4 + 2 = 0 при Ф = 4
Наибольшее число степеней свободы, равное 3, имеет однофазная система. Следовательно, в этом случае можно произвольно устанавливать и менять три условия: температуру, давление и концентрацию одного из компонентов.
В конденсированных системах (жидкое и твёрдое состояния, например, расплав – твёрдое состояние) изменение давления незначительно сказывается на свойствах, поэтому давление можно считать постоянным и уравнение примет вид С = К – Ф + 1, а фазовая диаграмма (в случае образования твёрдого раствора) будет иметь вид, представленный на рис. 5. Следовательно, двухкомпонентная конденсированная система в гомогенной области, где одна фаза, должна иметь 2 степени свободы, т.е. состояние системы определяется температурой и концентрацией одного из компонентов. Если двухкомпонентная система двухфазна, то степеней свободы будет одна. Это обозначает, что при изменении температуры изменяется концентрация обеих фаз. Типичная фазовая диаграмма двухкомпонентной системы (сплав двух металлов) представлена на рис. 13.
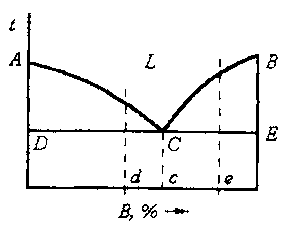
Рис.13. Фазовая диаграмма двухкомпонентной системы c полной нерастворимостью в твёрдом состоянии.
Здесь в области выше кривых (область «L») система однофазна и представляет собой расплав компонентов А и В. В этой области можно изменять концентрацию компонентов и температуру. Если систему произвольного состава охлаждать, то при достижении температуры, отвечающей точке на кривой ликвидуса, начнётся выделение кристаллов того компонента, к которому примыкает данная ветвь линии ликвидуса. По мере выпадения кристаллов этого компонента (например, компонента А) расплав будет обогащаться компонентом В и процентное содержание его будет возрастать, а компонента А - уменьшаться. При дальнейшем снижении температуры состав расплава будет изменяться по ветви ликвидуса, относящейся к компоненту А до точки C. В этой точке происходит выделение кристаллов обоих компонентов. Сплав этого состава называется эвтектическим. Эта точка соответствует одновременному существованию трёх фаз – одной жидкой и двух твёрдых (кристаллических). Соответственно, число степеней свободы равно нулю (конденсированные фазы). В области диаграммы АСD одновременно присутствуют жидкая фаза и кристаллы А. Соответственно в области ВСЕ присутствуют жидкая фаза и кристаллы В.
Если же в твёрдом состоянии наблюдается частичная растворимость компонентов (ограниченные твёрдые растворы), то фазовая диаграмма принимает вид как на рис. 14

Рис. 14. Фазовая диаграмма двухкомпонентной системы с ограниченной взаимной растворимостью компонентов в твёрдом состоянии.
Здесь в области α находится твёрдый раствор замещения с преобладанием компонента А, а в области β - твёрдый раствор замещения с преобладанием компонента В.
Разделения фаз, описываемые фазовыми диаграммами, имеют место в процессах синтеза полимеров, в процессах выделения веществ из смеси, в процессах формования полимерных структур, в процессах нанесения покрытий различной природы и к этим вопросам мы вернёмся в дальнейшем.
2.4. Процессы структурообразования.
При охлаждении расплава вещества, способного к кристаллизации, в зависимости от скорости охлаждения могут образовываться как кристаллические, так и аморфные (стеклообразные) структуры. Если кристаллизация началась, то кристаллы растут до тех пор, пока они не соприкоснутся своими краями друг с другом. При этом всё (или практически всё) вещество закристаллизовывается. Форма образующихся кристаллов может быть разнообразна. Для полимеров характерна кристаллизация в форме сферолитов.
При кристаллизации из раствора образуются индивидуальные кристаллы, форма которых зависит от многих факторов: температуры, степени пересыщения, природы растворителя, перемешивания, наличия растворимых примесей, нерастворимых примесей, готовой кристаллической поверхности, а также электрического поля, магнитного поля, радиоактивных излучений. В первую очередь перечисленные факторы влияют на скорость образования зародышей кристаллизации, а после возникновения устойчивых зародышей – на морфологию растущих кристаллов. (Морфология – от греч. мorphe - форма, учение о формах и строении)
Рост кристаллов из раствора включает целый ряд этапов: 1) подвод вещества к поверхности грани; 2) образование двухмерных зародышей, а также их рост; 3) отвод молекул растворителя, не вошедших в состав растущего кристалла, от его поверхности в объём среды; 4) отвод тепла, выделяющегося при кристаллизации.
При очень малых пересыщениях кристалл растёт главным образом в результате присоединения отдельных частиц (ионов или молекул) к местам нарушений кристаллической решётки: на молекулярных террасах, ступеньках и т.п. С уменьшением степени пересыщения раствора происходит выравнивание скоростей роста отдельных граней кристаллов и он оказывается огранённым б о льшим числом плоскостей, более равномерно развитых.
С увеличением степени пересыщения увеличивается разница в скоростях роста отдельных граней, а также общая скорость роста кристалла. При большом пересыщении возможно одновременное образование и разрастание нескольких плоских зародышей в различных местах одной и той же грани. В результате могут образовываться дефектные кристаллы, содержащие даже включения маточного раствора.
Высокое пересыщение раствора способствует и образованию дендритных (ветвистых, подобных узорам мороза на окнах) форм роста. Это объясняется более лёгким притоком кристаллизующегося вещества к вершинам кристалла. Росту дендритов также способствует отсутствие перемешивания, кристаллизация из вязких растворов, присутствие примесей, особенно поверхностно-активных веществ.
Перемешивание раствора облегчает процесс диффузии вещества из объёма среды к граням кристалла и ускоряет его рост. Благодаря этим наблюдениям была решена задача скоростного выращивания монокристаллов сегнетовой соли в промышленных условиях путём вращения затравочного кристалла в пересыщенном растворе. Скорость роста кристаллов в зависимости от скорости вращения кристалла вначале резко увеличивается, а затем довольно плавно достигает определённого предела, выше которого перемешивание бесполезно, а иногда и вредно. При перемешивании раствора обеспечивается равномерный приток кристаллизующегося вещества к различным граням, что способствует образованию кристаллов правильной формы.
С повышением температуры скорость роста кристаллов резко увеличивается. Это объясняется ускорением диффузионных процессов, увеличением коэффициента диффузии D, уменьшением толщины ламинарного слоя маточного раствора на поверхности кристалла.
Присутствие в растворе даже ничтожно малого количества примесей может оказывать существенное влияние на скорость роста отдельных граней кристалла, его форму, окраску, однородность. Некоторые примеси могут полностью приостановить рост кристалла даже при больших пересыщениях раствора, другие, наоборот, могут вызвать укрупнение кристаллов в процессе массовой кристаллизации.
При кристаллизации из газовой фазы вещество обычно кристаллизуется в дендритные формы. Примером могут служить снежинки, всегда имеющие гексагональный узор. В них из центрального ядра к периферии растут шесть лучей, которые затем разветвляются снова и снова, сохраняя общую гексагональную симметрию. Разнообразие ветвистых узоров снежинок неописуемо. Американский учёный У. Бентли много лет фотографировал снежинки и результаты этой кропотливой работы опубликовал в прекрасной книге, содержащей сотни фотографий (1931 г.).
Аналогично образуются дендритоподобные кристаллы металлов при разложении карбонилов металлов. Но, из-за большой массы (всё же металл, а не вода) происходит быстрое укрупнение частиц, которые в результате приобретают сферическую форму. Первоначальный размер частиц – несколько десятков ангстрем, что соответствует 102 – 103 атомов. Малый размер и неупорядоченность «первичных частиц» металла придают им огромные избытки энергии по сравнению с компактным стабильным металлом. Поэтому коагуляция этих частиц сопровождается их быстрым слиянием.
Аналогично образуются рыхлые хлопьевидные структуры при газофазной полимеризации.
Специфической и очень важной областью является нанесение вещества на подложку. В этом случае внешней средой может быть газообразная, жидкая или твёрдая фаза, а подложкой является всегда твёрдая фаза в виде моно-, поликристаллического или стеклообразного вещества или в виде композиционного материала. Примеров таких покрытия множество. Это металлические покрытия металлов и неметаллов, защитные (и декоративные) полимерные покрытия самых разнообразных материалов, композиционные покрытия различной природы, стекловидные неорганические покрытия и многие другие. В микроэлектронике огромное значение имеют эпитаксиальные покрытия.
2.4.1. Эпитаксия (от греч. еpi – на и taxis – расположение в порядке) – это процесс ориентированного нарастания, в результате которого образующаяся новая фаза закономерно продолжает кристаллическую решётку фазы – подложки с образованием переходного эпитаксиального слоя, при этом происходит срастание двух решёток по плоскостям и направлениям со сходной плотностью упаковки атомов.
Между двумя срастающимися фазами – подложкой и нарастающей фазой, образуется переходный эпитаксиальный слой (ПЭС), структура и химический состав которого определяется характером физико-химического взаимодействия в данной системе. В этом слое начинается и заканчивается собственно процесс эпитаксии.
Если структура срастающихся веществ подобна не только по строению кристаллических решёток, но и по характеру и типу связей атомов, её образующих, то такой процесс называют автоэпитаксия Обычно это бедные твёрдые растворы одного и того же вещества, например, р- и n-кремний. В этом случае образуется гомогенный электронно-дырочный переход.
Если химическая природа срастающихся фаз различна, но они не образуют друг с другом химических соединений, то такой процесс называют гетероэпитаксией. Переходный эпитаксиальный слой (ПЭС) в этом случае представляет собой твёрдый раствор. Чем меньше концентрационная область существования твёрдых растворов, тем тоньше ПЭС. При гетероэпитаксии формируется гетерогенный электрический переход, способный выполнять функции дискретных приборов. Примерами могут служить эпитаксиальные слои арсенида галия GaAs на фосфиде галия GaP, арсенида галия на селениде цинка ZnSe и др.
Если при наращивании происходит химическое взаимодействие вещества подложки с веществом, поступающим из внешней среды, то такой процесс носит название хемоэпитаксия. Полученное соединение отличается по химическому составу как от вещества подложки, так и от вещества, поступающего из внешней среды. Образующаяся фаза продолжает кристаллическую решётку подложки. Толщина хемоэпитаксиального слоя мала. Такие структуры могут образовывать как гетеропереход, так и невыпрямляющий контакт.
Во всех рассмотренных выше случаях рост новой фазы ориентируется структурой кристаллической решётки подложки. Возможно неориентированное (произвольно ориентированное) нарастание слоёв. В этом случае плёнка удерживается на поверхности подложки только силами межмолекулярного взаимодействия. При этом подложки могут быть моно-, поликристаллическими и стеклообразными, а нарастающая на них плёнка – поликристаллической или стеклообразной (аморфной).
Плёнка какой структуры (кристаллической или аморфной) будет образовываться при эпитаксиальном наращивании зависит от кинетики образования зародышей кристаллизации и роста кристаллов и степени переохлаждения. Ранее мы приняли, что обычно скорость роста кристаллов максимальна вблизи от Тпл, а максимум скорости образования зародышей кристаллизации – при более сильных переохлаждениях. В действительности встречаются и другие варианты. Так, для селена температура максимальной скорости роста кристаллов существенно ниже максимума скорости образования зародышей кристаллизации. В результате селеновые плёнки для выпрямителей всегда аморфны. Напротив, стеклообразующие вещества типа оксида кремния SiO2 или германия GeO2 и ряд других имеют максимальную скорость образования зародышей кристаллизации намного ниже Тпл, когда скорость роста кристаллов пренебрежительно мала. В результате такие материалы практически всегда находятся в стеклообразном состоянии.
На процесс ориентированного наращивания, в частности, на толщину ПЭС, влияют как внешние (технологические) факторы (качество подготовки поверхности подложки, температура, давление, концентрации и др.), так и внутренние факторы – характер физико-химического взаимодействия срастающихся веществ, отражающийся в диаграммах фазовых равновесий системы подложка – нарастающее вещество – примесь, электронное строение взаимодействующих атомов, структурно-геометрический фактор, температуры плавления и кипения и многие другие.
Электрические свойства металлических плёнок зависят от размеров кристаллитов, которые в свою очередь зависят от толщины плёнки - они увеличиваются с увеличением толщины (рис. 15). При толщине больше 60 нм по электрическому сопротивлению плёнки ведут себя как монолитные металлы (рис.16).
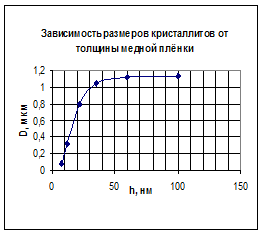
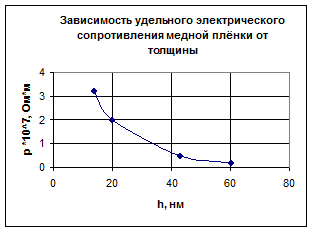
Рис.15. Зависимость размеров кристаллитов меди от толщины медной плёнки.
Рис.16. Зависимость удельного электрического сопротивления медной плёнки от её толщины (плёнки получены напылением меди на стеклянную подложку)
Эпитаксия, выражающаяся во влиянии подложки на морфологию кристаллов, наблюдается и в полимерах.
Эпитаксия – не единственная технология создания тонких плёнок (слоёв) на твёрдых поверхностях. Существует технология, основанная на свойствах жидкостей, на поверхностном натяжении жидкостей.
Учение о поверхностном натяжении обязано своим возникновением любознательности домохозяйки Агнесс Луизе Вильгельмине Покелс (1862 – 1935 гг, Брауншвейг, Нижняя Саксония)). Она заинтересовалась поведением системы вода – мыло – жир, провела огромное количество опытов по измерению усилия отрыва пуговицы от жидкой поверхности. Свои соображения представила на суд лорда Релея, который настоял на их публикации в 1891 году в журнале «Nature» под скромным названием «Поверхностное натяжение».
Четверть века спустя Ирвинг Ленгмюр (1881 – 1957), а за ним и другие учёные начали проводить интенсивные исследования в этой области. В 1931 году Ленгмюр за фундаментальные исследования поверхностного натяжения («щётка Ленгмюра», «ванна Ленгмюра») получил Нобелевскую премию. В этом же году домохозяйка Агнесса Покелес получила награду Коллоидного общества.
«Ванна Ленгмюра» представляла собой сосуд с подвижными стенками. За счёт этого можно было растягивать или сжимать слои мыла (ПАВ) на поверхности воды. Исследования в этом направлении Ленгмюр поручил своей сотруднице, высококвалифицированному учёному Катарине Блоджетт (1898 – 19…). Она придумала, как наносить эти слои на твёрдую поверхность. Метод («слои Ленгмюра – Блоджетт») заключается в подведении тонкой чистой пластинки стоймя под слой мыла и медленном вытягивании пластины вертикально вверх. Скорость вытягивания пластины должна соответствовать скорости сближения подвижных стенок с тем, чтобы не было разрыва сплошности мыльной плёнки. В таком эксперименте на поверхности пластины образуется гидрофобная плёнка толщиной 2 нм. Если теперь эту пластину погружать через мыльную плёнку в ванну, то на гидрофобной поверхности образуется плёнка, но теперь уже гидрофильная. Таким способом можно создавать покрытия любой толщины и любого состава, при этом можно регулировать и структуру этих слоёв. В частности, нанеся 44 мономолекуляных слоя стеарата бария, Блоджетт получила «невидимые» слои, пропускающие более 99% падающего света (1938 г.). Стёкла с такими слоями становятся идеально прозрачными и нашли широкое применение в оптике – «просветлённая оптика».
Этим методом сейчас на поверхности различных подложек получают тончайшие (толщиной в 1 атом) слои электропроводящих, полупроводниковых и магнитных веществ, наноразмерные диэлектрические покрытия и прослойки в электронных устройствах, используются для производства рентгеновских дифракционных решёток, газовых сенсоров, рабочих элементов так называемых первапорационных мембран, позволяющих разделять небольшие по размерам молекулы различных веществ и др.
2.5. Надмолекулярная структура полимеров.
Кристаллизация полимеров имеет существенные отличия от кристаллизации низкомолекулярных веществ в силу особенностей их молекулярного строения, а именно – анизометричности, т.е. огромных различий в поперечных и продольных размерах макромолекул.
В разбавленных растворах макромолекулы гибкоцепных полимеров приобретают глобулярную форму – форму статистических клубков. По мере увеличения концентрации (например, при испарении растворителя) клубки начинают разворачиваться. При этом участки цепей смежных клубков вынуждены укладываться параллельно и не обязательно «снопиком». Макромолекуле термодинамически выгодно многократно складываться самой на себя. Упакованные в пачки эти складчатые структуры называют кристаллитами. Кристаллиты являются минимальными дискретными элементами любой устойчивой надмолекулярной организации в твёрдых полимерах. А из кристаллитов образуются ламелярные кристаллы, монокристаллы, эдриты, аксиалиты, фибриллы, сферолиты. Для сравнения приведём их характерные размеры в ангстремах (1А = 10-10м)
Наименьший Наибольший
размер размер
Макромолекула 2 – 5 103 - 105
Кристаллит 20 – 100 100 – 500
Ламелярный кристалл до 100 104 - 105
Монокристалл 100 104 - 105
Эдриты, аксиалиты 102 - 104 104 - 106
Фибриллы 103 – 105 105 - 106
Сферолиты 105 - 107 Более 107
Ламелярный кристалл – это тонкий пластинчатый кристалл. Монокристаллы обычно имеют вид полой четырёхгранной пирамиды Полимерные монокристаллы удаётся вырастить только из разбавленных растворов путём их охлаждения. Эдриты и аксиалиты – это многогранные структуры. Эдриты – это образования, в которых хотя бы одна из проекций имеет вид многогранника. Аксиалиты имеют анизодиаметрическую форму. Граница между аксиалитами и эдритами условна, поэтому часто их называют одним термином, например, эдритами. Эти кристаллы занимают по сложности своего строения промежуточное положение между монокристаллами и сферолитами. Фибриллы – это кристаллы, по внешнему виду напоминающие плоские ленты. Из них строятся сферолиты – наиболее типичная форма кристаллизации полимеров как из раствора, так и из расплава.
Из этого не следует, что все остальные типы кристаллических образований полимеров имеют только академический (научный) интерес. Скажем, разработка синтеза некоторых полимеров в виде плоских монокристаллов решила проблему создания смазочных материалов, способных работать в условиях глубокого вакуума.


д)

е)
Рис. 17. Характерные кристаллические структуры полимеров.
а) монокристалл; б) радиальный сферолит; в) кольцевой сферолит; г) сферолитная цепочечная структура;д) сферолиты полипропилена; е) сферолиты поливинилиденфторида, а и е - электронная микроскопия, б, в, г и д – оптическая микроскопия, поляризованный свет.
Сферолиты – это весьма сложные и совершенные надмолекулярные кристаллические образования, формирующиеся на глубоких стадиях кристаллизации. Они представляют собой трёхмерное образование, симметричное относительно центра. В тонких плёнках диаметр сферолита может быть больше толщины плёнки и тогда образуется «двухмерный сферолит», представляющий собой фактически шаровой слой, вырезанный поверхностями плёнки из трёхмерного сферолита. Практическое значение имеет изучение стадий и механизмов образования сферолитов, расположение макромолекулярных цепей в сферолитах, поведение сферолитов в процессе деформирования полимеров и влияния их на свойства полимерных материалов.
Изучение структуры кристаллических полимеров, их смесей, в том числе и изоморфно-замещённых смесей полимеров, до, в процессе вытягивания и после вытягивания позволило определить механизм деформирования, заключающийся в рекристаллизации полимера в силовом поле. Суть этих представлений заключается в разрушении, «расплавлении» кристаллов под действием больших напряжений, ориентации макромолекул относительно оси растяжения и их последующей кристаллизации, закрепляющей эффект ориентации.
Как известно, кристаллические полимеры имеют так называемое «аморфно-кристаллическое строение». Этот термин подчёркивает неразрывность, неразделимость физическими методами аморфной и кристаллической фаз полимера. Одна и та же макромолекула может одновременно находиться в кристаллической области в составе ламелярного кристаллита, затем в аморфной области и вновь войти в состав другого кристаллита. Части макромолекул, находящиеся в аморфной области, называют проходными цепями. Соотношение кристаллической и аморфной областей зависит от температурно-временного режима кристаллизации. Так, сферолиты (ПЭ, ПП, ПА-66, полиформальдегид и др.), образованные при более высоких температурах и более быстром охлаждении, содержат значительное количество аморфной части (проходных цепей), а сферолиты, образованные при более низких температурах и медленном охлаждении, меньше по размеру, но более совершенны, доля кристаллической части выше (степень кристалличности выше).
Длительный отжиг при невысокой температуре обычно приводит к увеличению внутренней упорядоченности в сферолитах, росту размеров кристаллов, степени кристалличности, агрегации фибрилл, что сопровождается увеличением прочности и падением удлинения, смещением некоторых максимумов механических потерь в область высоких температур.
Механические свойства полимеров в изотропном состоянии и в ориентированном отличаются на порядки. Так, прочность на разрыв блочных изотропных полимерных материалов составляет обычно 50 - 100 МПа, в то время, как у волокон она может достигать тысяч МПа.
(Сюда можно вставить о связи структуры и прочности полимеров)
 2015-05-13
2015-05-13 3164
3164
