| Классификация электролитов | Сильные электролиты | Средние электролиты | Слабые электролиты |
| Значение степени диссоциации (α) | α>30% | 3%≤α≤30% | α<3% |
| Примеры | 1. Растворимые соли; 2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.)); 3. Сильные основания – щёлочи. | H3PO4 H2SO3 | 1. Почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2. Некоторые неорганические кислоты (H2CO3, H2S и др.); 3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); |
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H +).
!!! Кислота – донор протона.
Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато:
Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень) – дигидроортофосфат ион
Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH -) .
| Диссоциация щелочей | Диссоциация амфотерных оснований (амфолитов) |
| Вспомните! Щёлочи – это основания, растворимые в воде. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также N Н4ОН | Амфолиты - это электролиты, которые при диссоциации одновременно образуют катионы водорода (H +) и гидроксид-ионы (OH -). |
| Примеры уравнений диссоциации щелочей KOH -> K + + OH -; NH 4OH ↔ NH +4 + OH - Многокислотные основания диссоциируют ступенчато: Ba(ОН)2 -> Bа(ОН)+ + OH-(первая ступень) Ba(OH)+ ↔ Ba2++OH- (вторая ступень) | Примеры уравнений диссоциации амфолитов Н2O ↔ Н+ + ОН- Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением: 2ОН- + Zn2+ + 2Н2О ↔ Zn (ОН)2 + 2Н2О ↔ [Zn(ОН)4]2-+ 2Н+ |
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей:
(NH4)2SO4 -> 2NH+4+ SO2-4;
Na3PO 4 -> 3 Na + + PO 3- 4
Кислые же и основные соли диссоциируют ступенчато:
Например,
| Диссоциация кислых солей | Диссоциация основных солей |
| У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. KHSO4 -> K + + HSO -4 HSO -4 ↔ H + + SO 2-4 | У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg(OH)Cl -> Mg(OH)++ Cl - Mg (OH)+↔ Mg2+ + OH- |
Раствор – однородная система, состоящая из молекул растворителя и растворённого вещества, между которыми происходят физические и химические взаимодействия.
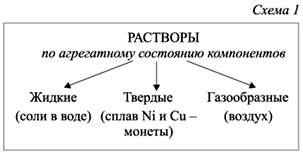
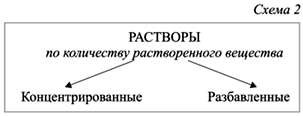
По растворителю: - водные; - неводные.
 Водный раствор поваренной соли NaCl
Водный раствор поваренной соли NaCl
|
| |||||||||||||||||
| |||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.При диссоциации ортофосфорной кислоты по второй ступени образуются ионы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
 2015-05-26
2015-05-26 3361
3361

