Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями.
В системе СИ единицей массы является кг, количества вещества – моль, объема – куб. м.
Молярная масса имеет размерность г/моль и числена равна 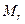 . Количественная характеристика
. Количественная характеристика
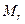 - моль. Различают моль молекул, атомов или ионов. Количества моль молекуь рассчитывают по формуле:
- моль. Различают моль молекул, атомов или ионов. Количества моль молекуь рассчитывают по формуле: 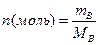
Известно несколько способов выражения концентрации растворов.
Массовая доля – масса вещества в 1 г или 100 г раствора.
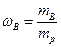

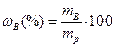 где
где 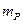 - масса вещества,
- масса вещества, 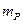 -масса раствора
-масса раствора
Молярная концентрация (– отношение количествавещества В (моль), содержащегося в системе, к объему V этой системы:
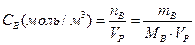 где n-число молей вещества; m-масса вещества, г; М-молярная масса вещества.
где n-число молей вещества; m-масса вещества, г; М-молярная масса вещества.
Молярную концентрацию выражают в 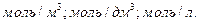 Вместо обозначений
Вместо обозначений 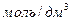 или моль/л допускается обозначение М.
или моль/л допускается обозначение М.
Моляльная концентрация ( 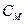 )– количество молей вещества в 1 кг растворителя..
)– количество молей вещества в 1 кг растворителя..
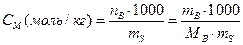 где
где 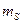 - масса растворителя
- масса растворителя
Молярная концентрация эквивалента 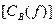 – отношение массы вещества (в молярных массах эквивалента), содержащейся в системе, к объему V этой системы.
– отношение массы вещества (в молярных массах эквивалента), содержащейся в системе, к объему V этой системы.
Молярных массах эквивалента вещества (моль) – это масса 1 моль эквивалента вещества, равная произведению фактора эквивалентности (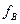 ) на молярную массу вещества В.
) на молярную массу вещества В.
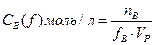
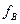 -фактор эквивалентности вещества В
-фактор эквивалентности вещества В
Молярная концентрация эквивалента выражают в 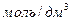
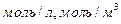 , принято называть нормальностью Допускают обозначение «н».
, принято называть нормальностью Допускают обозначение «н».
Фактор эквивалентности (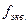 )– безразмерная величина- число, обозначающее, какая доля реальной частицы вещества x эквивалентна одному электрону в данной кислотно-основной реакции или одному электрону в данной ОВР.Для реакции
)– безразмерная величина- число, обозначающее, какая доля реальной частицы вещества x эквивалентна одному электрону в данной кислотно-основной реакции или одному электрону в данной ОВР.Для реакции 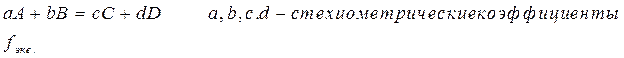 Одна частица А эквивалентна b/a частицам вещества B..
Одна частица А эквивалентна b/a частицам вещества B.. 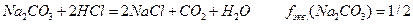
Фактор эквивалентности имеет вид меньше единицы.
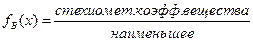
Например, для реакции 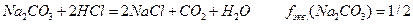
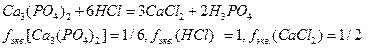
Между 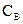 и
и 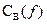 существует зависимость
существует зависимость 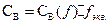
Молярная концентрация 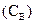 в 1/f раз меньше молярной концентрации эквивалента
в 1/f раз меньше молярной концентрации эквивалента
Молярная доля компонента в растворе
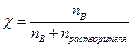
При взаимодействии растворов, концентрация которых выражена как нормальность, расчеты производят по выражению 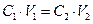
1.Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е. V1CН1 =V2CН2.
Нормальность раствора NaOH рассчитываем по формуле:
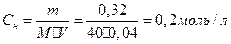
Из выражения 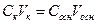
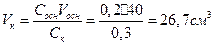
Ответ: 26,7 см  .
.
2.Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора 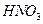 плотностью 1,12 г/
плотностью 1,12 г/ 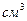 . Сколько граммов кислоты содержится в 4 л этого раствора?
. Сколько граммов кислоты содержится в 4 л этого раствора?
Решение. Массовая доля в процентах показывает количество граммов растворенного вещества в 100 г раствора. Следовательно, в 100 г раствора содержится 20,8 г 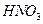 .
.
Масса растворителя в этом растворе составляет 100-20,8=79,2 г. Мольная масса 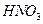 равна 63 г/моль. Моляльную концентрацию раствора находим из формулы:
равна 63 г/моль. Моляльную концентрацию раствора находим из формулы:
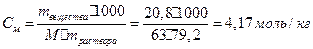
Эквивалентная масса 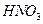 =М/1=63,0/1=63,0 г/моль, объем 100 г раствора находим из формулы
=М/1=63,0/1=63,0 г/моль, объем 100 г раствора находим из формулы 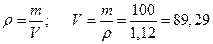 мл или 0,08929 л.
мл или 0,08929 л.
Эквивалентная концентрация или нормальность показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора, то из формулы
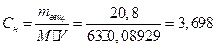 н.
н.
В 4 л этого раствора содержится:
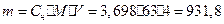 г кислоты.
г кислоты.
3. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора Н2SO4. Чему равны нормальность и титр раствора Н2SO4?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1CН1 =V2CН2 31*0,16=217 CН2, откуда CН2=31*0,16/217=0,02286 н.
Титром раствора называется число граммов растворенного вещества в 1 см3 (мл) раствора. Зная нормальность раствора и эквивалентную массу (mЭ) растворенного вещества, титр можно найти по формуле
Т=Сн mЭ/1000, откуда Т=0,02286*49/1000=0,001120 г/см3.
Ответ: 0,023 н.; 1,12*10-3 г/см3.
4. Растворимость гидрофосфата аммония в воде при 20°С 69г. Вычислить массовую долю и молярную концентрацию этого раствора, если r=1,21 г/мл.
Решение. Растворимость вещества измеряется содержанием вещества в его насыщенном растворе.
Коэффициент растворимости – масса вещества растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. при данной температуре.
Массовая доля – масса вещества в 1 г или 100 г раствора.
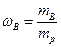

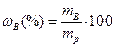 где
где 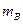 - масса вещества,
- масса вещества, 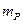 -масса раствора
-масса раствора
Молярная концентрация (– отношение количествавещества В (моль), содержащегося в системе, к объему V этой системы:
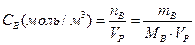 где n-число молей вещества; m-масса вещества, г; М-молярная масса вещества.
где n-число молей вещества; m-масса вещества, г; М-молярная масса вещества.
Молярную концентрацию выражают в 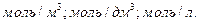 Вместо обозначений
Вместо обозначений 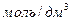 или моль/л допускается обозначение М.
или моль/л допускается обозначение М.
Из условий задачи и определения растворимости масса вещества 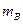 =69 г, масса растворителя
=69 г, масса растворителя 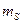 =100 г, масса раствора
=100 г, масса раствора 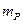 =100+69=169 г. Массовую долю раствора рассчитываем по уравнению:
=100+69=169 г. Массовую долю раствора рассчитываем по уравнению: 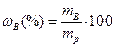 =
= 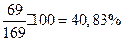 .
.
Молярная масса гидрофосфата аммония 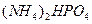 равна (14+4)х2+1+31+(16х4)=134 г/моль. Объем раствора
равна (14+4)х2+1+31+(16х4)=134 г/моль. Объем раствора 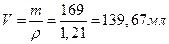 или 0,13967 л. Из выражения
или 0,13967 л. Из выражения

Ответ: 40,83%; 3,68 моль/л
5. Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора 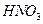 плотностью 1,12 г/
плотностью 1,12 г/ 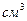 . Сколько граммов кислоты содержится в 4 л этого раствора?
. Сколько граммов кислоты содержится в 4 л этого раствора?
Решение. Массовая доля в процентах показывает количество граммов растворенного вещества в 100 г раствора. Следовательно, в 100 г раствора содержится 20,8 г 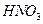 .
.
Масса растворителя в этом растворе составляет 100-20,8=79,2 г. Мольная масса 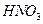 равна 63 г/моль. Моляльную концентрацию раствора находим из формулы:
равна 63 г/моль. Моляльную концентрацию раствора находим из формулы:
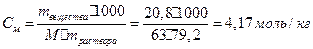
Эквивалентная масса 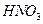 =М/1=63,0/1=63,0 г/моль, объем 100 г раствора находим из формулы
=М/1=63,0/1=63,0 г/моль, объем 100 г раствора находим из формулы 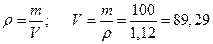 мл или 0,08929 л.
мл или 0,08929 л.
Эквивалентная концентрация или нормальность показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора, то из формулы
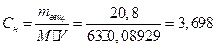 н.
н.
В 4 л этого раствора содержится:
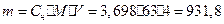 г кислоты.
г кислоты.
 2015-05-26
2015-05-26 2710
2710