Медь
… 3s23p63d104s1, степени окисления: +1, +2
| В природе | Физические свойства | |
| CuFeS2 – халькопирит Cu2S – медный блеск CuCO3∙Cu(OH)2 – малахит 2CuCO3∙Cu(OH)2 – азурит | tпл = 1083°C tкип = 2543°C r = 8,96 г/см3 | E0Cu2+/Cu0 = +0,377 В (при 25°C) |
| Высокая пластичность, тепло- и электропроводимость! Примеси увеличивают твердость, но примеси As, Sb и Pb уменьшают электропроводимость. |
Получение:
2Cu2S + 3O2 → t 2Cu2O + 2SO2
2Cu2O + Cu2S → t 6Cu + SO2
| • Отношение к неметаллам | • Отношение к кислотам |
| 2Cu + O2 → t 2CuO Cu + S → t CuS Cu + Se → t CuSe Cu + Cl2 CuCl2 | Cu + 2H2SO4 конц. → t CuSO4 + SO2 + 2H2O Cu + 4HNO3 конц. → Cu(NO3)2 + 2NO2 + 2H2O 3Cu + 8HNO3 разб. → 3Cu(NO3)2 + 2NO + 4H2O 2Cu + 4HClконц. → 2H[CuCl2] + H2 |
| • Отношение к растворам солей | |
| 2Cu + 4KCN конц. р-р. + 2H2O → 2K[Cu(CN)2] + 2KOH + H2 Cu + 2FeCl3 → CuCl2 + 2FeCl2 |
Соединения меди (I)
| Cu2O + 2HCl → 2CuCl + H2O Cu2O + 4HCl конц. → 2H[CuCl2] + H2O Cu2O +H2SO4 → CuSO4 + Cu + H2O 2CuCl → t Cu + CuCl2 | Восстановительные свойства: 2Cu2O + O2 + 8HCl → 4CuCl2 + 4H2O Комплексообразующая способность: Cu2O + 4NH3 + H2O → 2[Cu(NH3)2]OH |
| Окислительные свойства: Cu2O + CO → t 2Cu + CO2 Cu2O + H2 → t 2Cu + H2O |
Соединения меди (II)
| CuO + 2HNO3 → Cu(NO3)2 + H2O Cu(OH)2 → t CuO + H2O Слабо выражена амфотерность: Сu(OH)2 + 2HCl → CuCl2 + 2H2O Cu(OH)2 + 2NaOH конц. → Na2[Cu(OH)4] тетрагидроксикупрат натрия Cu(OH)2 + 4NH3∙H2O → [Cu(NH3)4](OH)2 + 4H2O Соли меди (II) слабо гидролизованы из-за образования устойчивых аквакомплексов: Cu2+ + HOH ↔ CuOH+ + H+; pH<7 | Окислительные свойства: 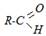 + 2Сu(OH)2 → t + 2Сu(OH)2 → t 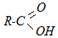 + Cu2O + 2H2O альдегид свежеосажд . 2CuSO4 + 4KI → I2 + 2CuI + 2K2SO4 CuCl2 + Cu 2CuCl Низшая термостойкость солей: 2CuI2 → t 2CuI + I2 2Cu(CN)2 → t 2CuCN + C2N2 + Cu2O + 2H2O альдегид свежеосажд . 2CuSO4 + 4KI → I2 + 2CuI + 2K2SO4 CuCl2 + Cu 2CuCl Низшая термостойкость солей: 2CuI2 → t 2CuI + I2 2Cu(CN)2 → t 2CuCN + C2N2 |
Упражнения и задачи к теме: «Медь и ее соединения»
1) Разделите смесь порошков цинка, меди и золота. Выделите металлы в свободном состоянии.
2) Осуществите превращения:

 → CuSO4 ↓
→ CuSO4 ↓
 а) Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu
а) Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu
→ K2[Cu(OH)4]
б) CuO →? → Cu(OH)2 → Cu(OH)Cl → CuCl2 → CuSO4
в) Cu →? → (CH3COO)2Cu →? → Cu(NO3)2 → CuO
3) Предложите метод извлечения меди из халькопирита CuFeS2 . Напишите уравнения реакций.
4) Из смеси оксида меди (II), алюминия и кремния выделите индивидуальные простые вещества. Напишите уравнения реакций.
5) Допишите уравнения реакций:
| а) FeCl3 р-р. + Cu → X + … X + NH3 р-р. → | б) Cu + Fe2(SO4)3 р-р.→ X + … X + Fe → |
6) Не прибегая к электролизу, из гидрида кальция и основного карбоната меди (II) получите два простых веществах.
7) Осуществите превращения:
а) X Y Cu(OH)2, X и Y – сложные вещества, содержащие медь
б) Cu2O X1
X4 ↑ ↓ BaCl2
 X3 ← X2
X3 ← X2
8) Закончите уравнения реакций:
Cu2O + HNO3 разб.→
Cu2S + HNO3 разб.→
Cu2S + KClO3 → t
9) При взаимодействии металла с концентрированной серной кислотой при нагревании масса выделившегося газа оказалась такой же, что и масса растворившегося металла. Назовите этот металл. Ответ подтвердите расчетом.
10) Смесь меди и оксида меди (II) массой 235,8 г нагревали в токе водорода, после чего масса остатка оказалась равной 228,6 г. Какова масса воды, образовавшейся в результате реакции?
 2015-05-30
2015-05-30 1036
1036






