Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями. Ниже приведены наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе:
| Способ выражения содержания растворенного вещества в растворе | Определение |
Массовая доля (С) Мольная доля (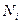 ) Молярная концентрация или молярность ( ) Молярная концентрация или молярность (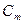 или М) Моляльная концентрация или моляльность (m) Эквивалентная концентрация или нормальность ( или М) Моляльная концентрация или моляльность (m) Эквивалентная концентрация или нормальность (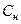 или н.) или н.) | Процентное отношение массы растворенного вещества к общей массе раствора; например, С=9,25% (масс) Отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. Например, в системе, состоящей из растворителя и единственного растворенного вещества, мольная доля последнего (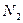 ) равна ) равна 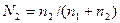 а мольная доля растворителя ( а мольная доля растворителя (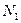 ) равна ) равна 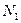 = = 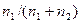 где где 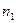 и и 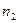 - соответственно количество вещества растворителя и количество растворенного вещества Отношение количества растворенного вещества к объему раствора; например, 1,5 М раствор или - соответственно количество вещества растворителя и количество растворенного вещества Отношение количества растворенного вещества к объему раствора; например, 1,5 М раствор или 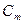 =1,5 моль/л Отношение количества растворенного вещества к массе растворителя: например, m=1,5 моль/кг ( =1,5 моль/л Отношение количества растворенного вещества к массе растворителя: например, m=1,5 моль/кг (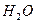 ) Отношение числа эквивалентов растворенного вещества к объему раствора; например, 0,75 н. раствор или ) Отношение числа эквивалентов растворенного вещества к объему раствора; например, 0,75 н. раствор или 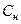 =0,75 моль/л Эквивалентные массы сложных веществ вычисляются по формулам: Эоксида=Моксида/Число атомов элемента∙валентность эл-та Экислоты=Мкислоты/ Основность кислоты Эоснования=Моснования/ Кислотность основания Эсоли=Мсоли/Число атомов металла∙валентность металла =0,75 моль/л Эквивалентные массы сложных веществ вычисляются по формулам: Эоксида=Моксида/Число атомов элемента∙валентность эл-та Экислоты=Мкислоты/ Основность кислоты Эоснования=Моснования/ Кислотность основания Эсоли=Мсоли/Число атомов металла∙валентность металла |
 2015-06-14
2015-06-14 1005
1005
