Многие химические реакции протекают в растворах. Растворы – это гомогенные (состоящие из одной фазы) многокомпонентные смеси переменного состава.
Условно компоненты раствора делятся на растворенные вещества и растворитель. Если раствор образуется при смешивании компонентов одинакового агрегатного состояния, растворителем считается компонент, которого в растворе больше. В остальных случаях растворителем является тот компонент, агрегатное состояние которого не меняется при образовании раствора, т.е. агрегатные состояния растворителя и раствора одинаковы.
Растворы бывают газообразные (воздух), твердые (многие металлические сплавы) и жидкие (морская вода – наиболее распространенный жидкий раствор различных солей и газов в воде). Практически наиболее важны жидкие растворы.
Растворимость – способность вещества растворяться в том или ином растворителе, она показывает сколько грамм вещества может раствориться в 100 г растворителя.
Кристаллогидраты – кристаллические вещества, в состав которых входит 1-2 или более моль воды: CuSO4 ´ 5H2O.
Для выражения состава раствора и содержания растворенного вещества применяют различные способы.
Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном массовом или объемном количестве раствора или растворителя.
Процентная концентрация (%) показывает, сколько граммов растворенного вещества приходится на 100 г раствора. Процент – сотая доля какого либо числа. Например, 20%-й раствор H2SO4 означает, что в 100 г этого раствора содержится 20 г H2SO4.
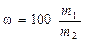 ,
,
где w - массовая доля, %, растворенного вещества; m1 - масса растворенного вещества, г; m2 - масса раствора, г.
Молярная концентрация раствора С м, М. Молярная концентрация (молярность) раствора показывает количество моль растворенного вещества, содержащегося в 1 л раствора (моль/л):
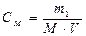 ,
,
где m1 - масса растворенного вещества, г; М - молярная масса растворенного вещества, г/моль; V - объем раствора, л.
Молярная концентрация эквивалента С n. Эквивалентная или нормальная концентрация (нормальность) показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора (моль·экв/л или экв/л):
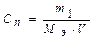 ,
,
где m1 - масса растворенного вещества, г; Мэ - молярная масса эквивалента растворенного вещества, г/моль; V - объем раствора, л.
Моляльная концентрация раствора C m. Моляльная концентрация раствора показывает количество моль растворенного вещества в 1 кг растворителя (моль/кг):
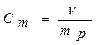 ,
,
где mр - масса растворителя, кг; n - количество растворенного вещеcтва, моль.
Титр раствора Т. Титр раствора показывает сколько граммов растворенного вещества содержится в 1 мл раствора (г/мл):
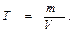
 2015-05-13
2015-05-13 5613
5613