Раствор с точно известной концентрацией, например раствор 0,1 М HCl, из фиксанала, содержащего точно отмеренный объем раствора вещества (HCl), готовят следующим образом.
В мерную колбу 1 емкостью 1 л вставьте воронку 2 диаметром 8 – 10 мм. В воронку поместите боек 3 (набор бойков есть в каждом наборе ампул с фиксаналом), утолщение которого не позволяет ему провалиться в воронку. Если боек правильно установлен в воронке, его острый конец должен быть направлен вертикально вверх (рис. 4.1).
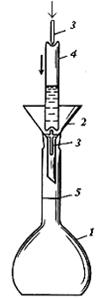 Возьмите ампулу 4, в которую запаяно необходимое для приготовления 1 л заданного раствора количество вещества (фиксанал). Ампула имеет углубления с двух сторон. Ударьте одним из этих углублений об острый конец бойка 3. Затем другим бойком 3¢ пробейте верхнее углубление ампулы (рис. 4.1).
Возьмите ампулу 4, в которую запаяно необходимое для приготовления 1 л заданного раствора количество вещества (фиксанал). Ампула имеет углубления с двух сторон. Ударьте одним из этих углублений об острый конец бойка 3. Затем другим бойком 3¢ пробейте верхнее углубление ампулы (рис. 4.1).
Не изменяя положения ампулы, дайте стечь ее содержимому в колбу и тщательно промойте ее изнутри с помощью промывалки дистиллированной водой (объем воды должен быть равен примерно 6-кратному объему ампулы). Затем удалите пустую ампулу.
 Доведите объем раствора дистиллированной водой до метки 5, закройте ее пробкой и тщательно перемешайте.
Доведите объем раствора дистиллированной водой до метки 5, закройте ее пробкой и тщательно перемешайте.
При приготовлении раствора из фиксанала твердого вещества, например 0,1 М раствора NaOH, осторожно переносят навеску заданного вещества из ампулы в мерную колбу (1 л), как описано выше. Затем в колбу наливают дистиллированной воды на 1/3 ее объема и при непрерывном перемешивании растворяют все кристаллы твердого вещества. После этого доводят объем раствора до метки дистиллированной водой, закрывают пробкой и еще раз тщательно перемешивают.
На колбу с готовым раствором наклеивают этикетку с названием и концентрацией раствора.
Работа 4.2. Приготовление раствора H2SO4 разбавлением.
Однако во многих случаях бывает необходимо использовать готовый раствор, доводя его концентрацию до нужной либо добавляя растворитель, – разбавляя раствор; либо добавляя растворенное вещество.
Так, при приготовлении растворов кислот исходят из соответствующих растворов концентрированных кислот. При этом на основании их плотности и отвечающей ей процентной концентрации вычисляют, какой объем соответствующей кислоты нужно взять для получения заданного объема рабочего раствора.
Методика вычислений, проводимых в подобных случаях, приводится на следующем примере.
Пример. 2. Сколько миллилитров концентрированной серной кислоты плотностью 1,84 г/мл, содержащей 96 % Н2SО4, нужно взять для приготовления 500 мл 3,7 М раствора кислоты с плотностью 1,22 г/мл.
Решение. Вычислим, прежде всего, сколько граммов безводной серной кислоты потребуется для приготовления заданного объема 3,7 М раствора. В 1 л 3,7 М раствора содержится 3,7 моля Н2SО4(М (Н2SО4) = 98 г/моль), тогда масса кислоты в 500 мл раствора составит: m = 3,7×98×0,5 = 181,3 г.
Вычислим далее, в каком количестве 96 % серной кислоты содержится 181,3 г безводной Н2SО4:
100 г раствора 96 % кислоты содержат 96 г Н2SО4
x г раствора 96 % кислоты содержат 181,3 г Н2SО4
x = (100´181,3)/96 = 188,9 г.
Теперь от найденной массы концентрированной серной кислоты перейдем к ее объему V = m /r =188,9/1,84 = 102,6 мл.
Следовательно, для того, чтобы приготовить 500 мл 3,7 М раствора серной кислоты нужно отмерить мензуркой 102,6 мл концентрированной серной кислоты и разбавить ее водой (вливая кислоту в воду) до 500 мл.
 2015-06-14
2015-06-14 723
723








