1. На титрование 100 см3 воды, содержащей гидрокарбонат магния, ушло 12 см3 0,15 н раствора HCl. Написать уравнение протекающей реакций. Рассчитать жесткость воды и определить массу соли, содержащейся в 40 л этой воды.
 | РЕШЕНИЕ: Составляем уравнение реакции: Mg(HCO3)2 + 2HCl = MgCl2 + + 2H2O + 2CO2↑ Ж = 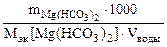 = = = =  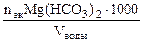 . . |
Согласно закону эвивалентов
nэкMg(HCO3)2 = nэк(HCl) = Cэк(HCl)·V 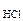
откуда
Ж = 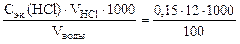 = 18 ммоль/л.
= 18 ммоль/л.
Определяем массу гидрокарбоната магния содержащейся в 40 л воды:
Ж = 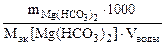 , откуда
, откуда
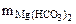 =
= 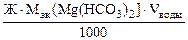 =
=
= 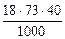 =52,56 г.
=52,56 г.
Мэк[Mg(HCO3)2] = 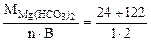 =73 г/моль (мг/ммоль);
=73 г/моль (мг/ммоль);
Ответ: Ж = 18 ммоль/л, 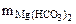 = 52,56 г.
= 52,56 г.
2. При кипячении 2 л воды (при рН>10,3), содержащей только гидрокарбонат магния, образовался осадок массой 28 мг. Написать уравнение протекающей реакции. Определить жесткость воды и массу соли в 0,5 м3 этой воды.
|
 | РЕШЕНИЕ: При кипячении воды, содержащей гидрокарбонаты кальция, магния или железа, осадок выпадает в результате следующих реакций: |
Сa(HСО3)2 = CaCO3↓ + H2O + CO2↑
Mg(HCO3)2 = Mg(OH)2↓ + 2CO2↑ (при рН>10,3)
Fe(HCO3)2 = Fe(OH)2↓ + 2CO2
Так как все вещества реагируют и образуются в равных количествах их эквивалентов: nэк(Mg(HCO3)2) = nэк(Mg(OH)2), поэтому жесткость можно рассчитать по массе осадка гидроксида магния.
Ж = 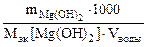 =
= 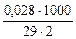 = 0,48 ммоль/л
= 0,48 ммоль/л
Мэк[Mg(OH)2] = 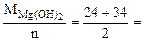 29 г/моль (мг/ммоль)
29 г/моль (мг/ммоль)
Массу гидрокарбоната магния в 0,5 м3 воды определяем по формуле.
Ж = 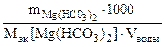
откуда 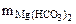 =
= 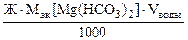
Мэк[Mg(НСO3)2] = 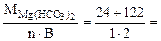 73 г/моль (мг/ммоль)
73 г/моль (мг/ммоль)
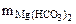 =
= 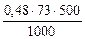 = 17,52 г.
= 17,52 г.
Ответ: Ж = 0,48 ммоль/л, 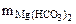 = 17,52 г.
= 17,52 г.
3. Для устранения жесткости к 10 л природной воды, которая содержит 0,015% гидрокарбоната кальция и 0,005% гидрокарбоната магния, добавили гашеную известь. Плотность воды 1 г/см3. Написать уравнения протекающих реакций. Определить массу гашеной извести, необходимую для устранения временной жесткости.
 | РЕШЕНИЕ: Гидроксид кальция Ca(OH)2 (гашеная известь) используется для устранения временной жесткости. При этом протекают следующие реакции: |
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O
Mg(HCO3)2 + 2Ca(OH)2 = Mg(OH)2↓ + 2CaCO3↓ + 2H2O
Необходимые для расчета массы солей найдем по их массовым долям в воде
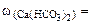
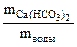 ∙100
∙100
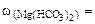
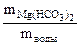 ∙100
∙100
Откуда 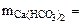
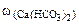 ∙10-2 ∙mводы =
∙10-2 ∙mводы = 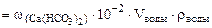 = 0,015·10-2 10·103·1 = 1,5 г.
= 0,015·10-2 10·103·1 = 1,5 г.
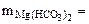
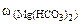 ∙10-2 ∙mводы =
∙10-2 ∙mводы = 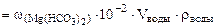 = 0,005·10-2·10·103·1 = 0,5 г.
= 0,005·10-2·10·103·1 = 0,5 г.
Ж = 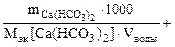
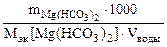 =
=
= 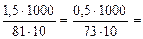 2,53 ммоль/л.
2,53 ммоль/л.
Мэк[Сa(НСO3)2] = 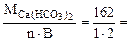 81 г/моль (мг/ммоль)
81 г/моль (мг/ммоль)
Мэк[Mg(НСO3)2] = 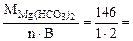 73 г/моль (мг/ммоль)
73 г/моль (мг/ммоль)
Массу гашеной извести, необходимую для устранения временной жесткости рассчитываем по уравнениям реакции:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O
 162 г 74 г
162 г 74 г 
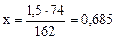 г
г
 1,5 г х
1,5 г х
Mg(HCO3)2 + 2Ca(OH)2 = Mg(OH)2↓ + 2CaCO3↓ + 2H2O
 146 г 2·74 г
146 г 2·74 г 
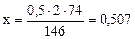 г
г
 0,5 г х
0,5 г х
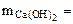 0,685 + 0,507 = 1,192 г.
0,685 + 0,507 = 1,192 г.
Ответ: 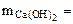 1,192 г.
1,192 г.
 2015-06-05
2015-06-05 2513
2513

 = 100 см3
= 100 см3 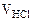 = 12 см3
= 12 см3 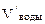 = 40 л Сэк(HCl) = 0,15 моль/л
= 40 л Сэк(HCl) = 0,15 моль/л 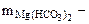 ? Ж -?
? Ж -? 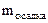 = 28 мг = 0,028 г.
= 28 мг = 0,028 г. 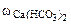 =0,015%
=0,015% 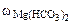 =0,005%
=0,005% 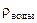 = 1 г/см3
= 1 г/см3 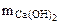 -?
-? 






