1. Результаты измерений занести в таблицу по форме 1.
Таблица...
Результаты поляризационных измерений
| Рабочий электрод (РЭ) – никелевая пластина размером 1х1 см (S, см2) | |
| Вспомогательный электрод (ВЭ) – платиновая проволока | |
| Электрод сравнения (ЭС) – хлорсеребряный (Е, В) | 0,222 |
| Темапература, С |
Измерение потенциала рабочего электрода в отсутствии тока:
| Вариант | Концентрация K3[Fe(CN)6], моль/л | Стационарный потенциал, мВ |
| 0,05 | 278,25 | |
| 0,1 | 285,15 |
Рассчитаем величины н основе полученных значений по формулам:
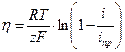
| [1.1] |
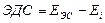
| [1.2] |
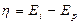
| [1.3] |
| Ei, В | Ep, В | Eэс, В | ЭДС, В | ηдиф, мВ | I, мА | i, мА/см2 | |
| Экспер. | Расчет. | ||||||
| 282,530 | 278,25 | 222,0 | -60,530 | -4,280 | -0,980 | 0,082 | 0,410 |
| 283,520 | 278,25 | 222,0 | -61,520 | -5,270 | -3,398 | 0,277 | 1,387 |
| 285,550 | 278,25 | 222,0 | -63,550 | -7,300 | -6,402 | 0,508 | 2,538 |
| 288,650 | 278,25 | 222,0 | -66,650 | -10,400 | -10,053 | 0,770 | 3,848 |
| 292,210 | 278,25 | 222,0 | -70,210 | -13,960 | -13,479 | 0,999 | 4,993 |
| 293,160 | 278,25 | 222,0 | -71,160 | -14,910 | -15,270 | 1,112 | 5,562 |
| 299,210 | 278,25 | 222,0 | -77,210 | -20,960 | -18,770 | 1,323 | 6,616 |
| 303,420 | 278,25 | 222,0 | -81,420 | -25,170 | -23,455 | 1,584 | 7,918 |
| 308,190 | 278,25 | 222,0 | -86,190 | -29,940 | -27,843 | 1,807 | 9,033 |
| 313,000 | 278,25 | 222,0 | -91,000 | -34,750 | -32,336 | 2,016 | 10,078 |
| 316,180 | 278,25 | 222,0 | -94,180 | -37,930 | -34,943 | 2,129 | 10,643 |
| 322,470 | 278,25 | 222,0 | -100,470 | -44,220 | -41,596 | 2,392 | 11,959 |
| 328,470 | 278,25 | 222,0 | -106,470 | -50,220 | -49,074 | 2,649 | 13,246 |
| 337,610 | 278,25 | 222,0 | -115,610 | -59,360 | -57,093 | 2,886 | 14,429 |
| 348,430 | 278,25 | 222,0 | -126,430 | -70,180 | -65,061 | 3,087 | 15,433 |
| 355,380 | 278,25 | 222,0 | -133,380 | -77,130 | -68,315 | 3,160 | 15,799 |
| 376,080 | 278,25 | 222,0 | -154,080 | -97,830 | -83,643 | 3,448 | 17,240 |
| 413,550 | 278,25 | 222,0 | -191,550 | -135,300 | -99,445 | 3,666 | 18,332 |
| 449,880 | 278,25 | 222,0 | -227,880 | -171,630 | -130,194 | 3,937 | 19,686 |
| 503,880 | 278,25 | 222,0 | -281,880 | -225,630 | -167,803 | 4,107 | 20,534 |
| 511,350 | 278,25 | 222,0 | -289,350 | -233,100 | - | 4,265 | 21,327 |
2. По результатам поляризационных измерений построить графики зависимости i–E в единой системе координат. Значения катодных плотностей тока и катодных потенциалов откладывать на положительных осях, для анодных плотностей тока и потенциалов – на отрицательных осях.
3. Для катодно-анодной кривой построить графики зависимости i–η по экспериментальным и рассчитанным значениям ηдиф..
4. По кривым i-E определить значения предельных токов катодного и анодного процессов.
5. По катодно-анодной кривой определить значение Е1/2 и сопоставить его со значением стандартного потенциала E° пары Fe(CN)63–/Fe(CN)64–.
6. Рассчитать значения эффективной толщины диффузионного слоя δэфф. или коэффициент массопереноса D/δэфф. Результаты всех расчетов свести в таблицу по форме 2.
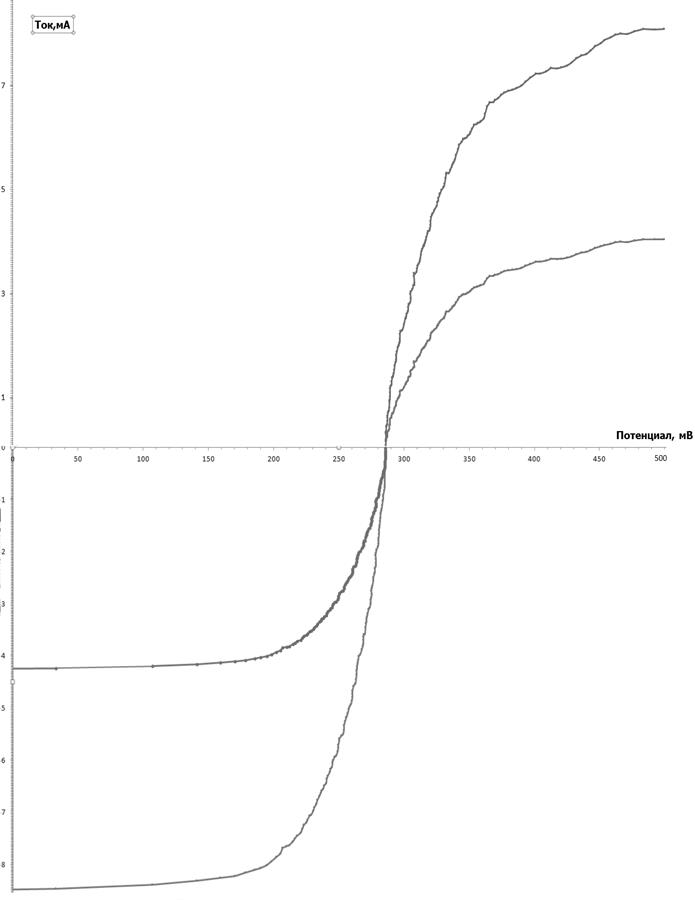
i пр Ox [0.05M]= 4,26 мА
i пр Red = [0.05M]= - 4,92 мА
i пр Ox [0.1M]= 8.53 мА
i пр Red = [0.1M]= - 8.94 мА
Таблица 2
Результаты расчетов электрохимических параметров
| Условия опыта (по заданию) | i пр.к., А/м2 | i пр.а., А/м2 | Е1/2, В | Е°, В | δэфф., м | D/δэфф., мс–1 |
| C [K3[Fe(CN)6]]= 0,05 моль/л | -24,6 | 21,3 | 0,28 | +0,54 | 0,000104 | 0,000004 |
| C [K3[Fe(CN)6] ]= 0,1 моль/л | -44,7 | 42,65 | 0,28 | +0,54 | 0,000104 | 0,000004 |
Расчетные формулы:
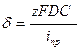
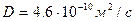
Стандартный электродный потенциал E° пары Fe(CN)63–/Fe(CN)64– равен +0,54 В
Вывод:
В ходе работы было сделано следующее:
1. Изучено влияние концентрации реагирующих ионов на величину предельного диффузионного тока в окислительно-восстановительной системе.
2. По полученным результатам построены поляризационные кривые в координатах: потенциал электрода (В) – плотность тока (А/м2) и определены предельный диффузионный ток i пр. и потенциал полуволны Е1/2.
3. С ростом концентрации реагирующих ионов в 2 раза величина предельного диффузионного тока также повысилась в 2 раза.
4. По катодно-анодной кривой определено значение Е1/2 и сопоставлено со значением стандартного потенциала E° пары Fe(CN)63–/Fe(CN)64–.
5. Рассчитаны значения эффективной толщины диффузионного слоя δэфф. и коэффициента массопереноса D/δэфф.
 2015-06-26
2015-06-26 290
290







