Синг. Ромб.
Структура молекулярна – кільцеві молекули S8
Форма кристалів обрізані дипіраміди, пінакоїдальні, ромботетраедричні.
Скелетні кристали. Порошкові, зливні, натічні маси.
Колір яскраво-жовтий – коричневий – яскраво-червоний –чорний
Вулканічна - зеленувато-жовта..Відома біла та голуба сірка. Блиск скляний до масного. Тв. 1-2
Густина 2.
Походження –
- вулканічна: сольфатарна (на родовищі Матсуо, Японія запаси 50 млн. Т)
Вилив сольфатарної лави сірки на вулкані Сіретоко-Йосан, Японія потужністю 5 м та шириною до 30 м. Лавовий потік коло Мауна-Лоа, Гаваї.
- Зона окислення сульфідних родовищ
- Біогенно-осадова (асоціація з гіпсом, галітом, баритом, целестином)
Родина самородного вуглецю С
5 мінеральних видів: алмаз, графіт, карбін, лонсделеїт, чаоіт
графіт формується в умовах низьких тисків, алмаз в умовах високих тисків, решта в умовах надвисоких тисків в зонах ударного метаморфізму.
Аморфна різновидність – шунгіт
Графіт
Гекс. 2H та триг. 3К політипи
Колір чорний до сріблясто-чорного, блиск металічний, бляклий. Досконала сп.
Подібний на молібденіт.
Походження магматичне, метаморфічне, гідротермальне, контактово-метаморфічне по вугіллю в трапах.
Зміна параметру с гратки в залежності від температури.
Алмаз
Встановлені домішки H, B, N, O.
Морфологія
Алмази із оболонкою
Відміни – борт, баллас, карбонадо.
Розмір: - великі – 5-10 карат до 3106 кар «Кулінан». Великі алмази «Ексцельсіор», «Зірка С’єра-Леоне». Зросток карбонадо – 3087 кар
Колір – безколірний, жовтий (N), вишнево-димчастий (B), рожевий (за рахунок пластичної деформації), чорний
Найбільші родовища.
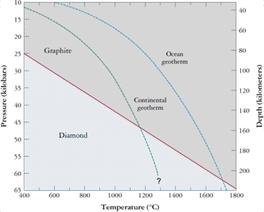
Походження: кімберліти, на глибинах 100-200 км (5-9 Гпа), температури 1150-1700 С; мета кімберлітові та пікритові дайки; високо баричні метаморфізовані породи Кустанайського масиву.
 1. 1. | 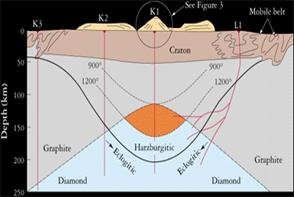 2. 2. | |
 3. 3. | Рис.
|
Розсипища алмазу
Штучне отримання алмазу.
Підтип 2. Полуметаллы і полуметаллиды.
Клас 2.1. Полуметаллы і интерполуметаллы (). Донорно-акцепторная зв'язок.
Група миш'як а- сурми.
Миш'як. Сурма. Аллемонит.
Група вісмуту. Вісмут..
Підтип 3. Гомоатомные неметаллы і неметаллиды.
Клас 3.1.Мінерали сірки і її гомологов.
Изоморфно-гомологическая група сірки.
Сірка. Селен. Телур.
Звідси тягнеться ланцюжок інших неметаллидов - великих з'єднань сірки і її аналогів із різноманітними полуметаллами і металами - утворюючих общирныый тип 3. Халькогениды і їхні аналоги.
Клас 3.2. Мінерали вуглецю
Полиморфная група самородного вуглецю
Діамант. Графіт. Лонсдейлит. Фуллерит..
Сполуки вуглецю з іншими елементами подано мінералами різноманітних класів. Сполуки з
близькими по складі і властивостями сусідами по Періодичній системі утворять самостійний тип
неметаллидов. Сполуки вуглецю з киснем - карбонати подані мінералами самостійного
класу. Сполуки з воднем виявляє графіт вуглеводні.
Клас 3.3. Неметаллиды.
Тут объеденены мінерали більш характерні для космосу - Сполуки неметаллов із близькими сусідами
по Періодичній таблиці. Загальна особливість неметаллидов - ковалентные зв'язки, діамантовий блиск висока
твердість, що сполучиться з для деяких представників установлені полиморфные модифікації і
политипии. Мінерали рідкісні, за винятком муассанитаЪЪ, що частіше зустрічається.
Група боридов.
Шрейберзит
Група карбидов.
Муассанит. Когенит.
Група силицидов
Ферсилицид.
Група азидов
Сидероазот
Група фосфиов.
Осборнит.
Від металлидов, полуметаллидов і неметаллидов, просліджуються генетичні зв'язки з більш
поширеними гетероатомными мінералами - халькогенидами оксигенидам і галогенидам.
2. Тип хімічного зв'язку, структура і властивості.
У залежності від електронної будівлі взаємодіючі атоми надаються в стані
хімічного зв'язку різного типу. Гомоатомные Сполуки неметаллов здійснюється ковалентной, або полярним зв'язком.
У самородних неметаллов ступінь ковалентности увеличивется від телуру до селену і сірки і досягає
межі в мінералах вуглецю
Діамант. У мінералах вуглецю, поданих декількома полиморфными модифікаціями,
ковалентная межатомная зв'язок зобов'язаний sp3- або sp2-гибридизации.
Малюнок структура діаманту
У першому випадку чотири що зв'язують орбитали, тетраэдрически ориентироуванные під рогом 108,28 про,
забезпечує відповідну тетраэдрическую координацію атомів вуглецю щодо один одного з
утворенням плотнейшей кубічної гранецентрированной елементарного осередку в діаманті і гексагональной
- у лонсделлите (межатомное відстань - 0.0722 Ао). Звідси характерна для діаманту велика енергія
хімічна зв'язку, прозорість в усім оптичному діапазоні, високий показник переломлення світла і
дисперсія, термо-химическая усталеність і максимальна твердість і гранична теплопровідність. З
ізоморфними домішками атомів азоту, бора,
і з вакансіями атомів вуглецю пов'язані фарбування, люмінесценція, напівпровідникові і прочностные
властивості діаманту.
У графіті реалізується гибридизация трьох орбиталей, що зв'язують атоми вуглецю з утворенням із
гексагональных плоских сіток гексагональной шаруватої структури графіту (межатомные відстані
=0.665Ао) і сферично-порожнистої структури фуллерита. Четвертий електрон кожного атома вуглецю в графіті
делокализуется і бере участь у слабкій п-связи (Ван-дер-Ваальсовой зв'язку) між гексагональными сітками (
відстань між плосккими сітками = 3.37Ао). З цим пов'язана властивому графіту низькі значення
твердості 1 і щільності = 2.2, зроблена спайність, висока електропровідність і непрозорість у
видимій області світла (цвіт від темно-сірого до чорного).
Вищий ступінь прояву ковалентной полярного зв'язку в діаманту і лонсдейлита з s-p3 - гибридизацией
орбиталей, орієнтованих завдяки силам отталкивания під рогом 109 28', що пояснює
тетраэдрическую координацію кожного атома вуглецю з межатомным відстанню R= 1. 444А°. У графіту й
інших полиморфных модифікацій вуглецю реалізуються ковалентные зв'язки з s-p2 - орбиталями
находящимися під рогом 120 щодо один одного, що забезпечують трикутну координацію атомів
вуглецю в плоских гексагональных сітках на відстані 1.42 А°; на їхнє периферії зв'язку
нескомпенсированы. Між вуглецевими сітками зв'язку забезпечуються p - електронами, що утримують
їх на відстані 3.44 А°. У цій площині дуже слабкі зв'язки і тут розколюються зразка графіту,
виявляючи вельма зроблену спайність.
Діамант найцінніший технічний камінь, виняткова твердість, Врощзрачность у широкому діапазоні
довжин хвиль, теплопровідність. Декілька десятків областей застосування виняткових електронних і фізико-механічних властивостей. Але головне - це ювелірне використання діаманту. Для видобувних країн - діамант - джерело валютних надходжень. У прирде діамант зустрічається в основному у виді кристалів
октаэдрической форми, часто зі ступечатыми гранями (111), що дають комбінаційні
ромбододекаэдрические грані з грубим штрихуванням. Звичайно мають справу також з уламками кристалів.
Часто зустрічаються також кристали кубічного габитуса, ромбододекаэдрические й округлі кристали, що
несуть риси розчинення. Кристали звичайно мають неоднорідну будівлю, обумовлена зміною умов росту. Часто кристали мають зонально-секториальное будівлю. Іноді діамант поданий сферолитами. Характерні сплощені двійники. Зернисті агрегати баллас, борт і карбонадо зустрічаються досить рідко.
Діаманти лтличаются високою чистотою хімічного складу. На 99.98 % це вуглець. Інше домішка
азоту, хоча в діаманті самими дошкульними методами виявлено 60 хімічних елементів. Закон
Вернадского.
Незважаючи на сталість складу діаманту, його властивості надзвичайно мінливі, що визначає його
технічні властивості і ювелірні якості. У основному це пов'язано з вплив азоту і різноманітних форм
його в структурі діаманту. По утриманню всі діаманти діляться на дві группы- переважну 1 із високим
утриманням і більш рідкісну Iс низьким утриманням азоту. Перший тип поглощет у ИК діапазоні між 8 и10 мкм., У УФ діапазоні до 330нм, а другий прозорий в обох інтервалах, тверже, більш теплопроводен,
мати більш високою фотопроводимостью. Азот у сполученні з вакансіями утворить множина дефектів,
частина яких відповідальний за поглинання світла, люмінесценцію і впливає на інші фізичні
властивості., У діамантах II типу переважають одиночні атоми азоту в асоціації з вакансіями. У діамантах
другого типу азот поданий різноманітними сегрегаціями, продуктами высокотемпературного отжига й
упорядкування одиночних дефектів з утворенням микровключений азоту і вакансій у виді платівок,
орієнтованих по кубі й октаэдру.
Фарбування і люмінесценція пов'язана з дефектами, що містять нечетное число атомів азоту - носіїв
неспаренных спинов, поза залежністю від концентрації азоту.
Якість діамантів як ювелірних каменів визначається по розмірах, формі кристалів, цвіту і
чистоті-утриманню вмикань. Цінність кожного кристала діаманту визначається вартістю діаманту, що можна приготувати з нього. Тому важливе раціональне огранювання з максимальним виходом і
мінімальними втратами., із мінімальною кількістю вмикань, із високою якістю цвіту і якістю
огранювання. 4С-карат, цвіт, чистота, огранювання.
Огранювання посилює оптичні властивості, блиск, дзеркальне і повне внутрішньо відбиток світла. Дисперсію, фарбування. Ідеальне огранювання Толковского.
Діагностика діамантів. Щодо проста у виді природних кристалов кубічної сингонии. Важлива
особливо в ювелірній справі, тому що є множина імітацій. Твердість. Щільність. Оптичні
властивості - блиск і дисперсія, аномальна анизотропия. Люмінесценція. Вмикання. Тест на теплопровідність. Завжди холодний. Якщо подихати на чисту грань- покриється крапельками роси.
Пошукові ознаки діаманту - у шлихах люмінесценція, щільність, блиск, супутники - червоний гранат пироп, ильменит, циркон...
Сірка. У самородної сірки атоми знаходяться в ковалентно -молекулярних зв'язках. Вони утворять восьмерные
каблучки, у яких забезпечується повне насичення електронами s2-p6- орбиталей сусідніх атомів. Між
каблучками здійснюються слабкі межмолекулярные зв'язки.
У сірки і її аналогів кожний атом пов'язаний із сусідніми двома атомами завдяки p4 гибридизации. У структурі селена і сірки вони утворять спіральні ланцюжки, а в структурі сірки ланцюжки замкнуті в спіральні восьмі-восьмі-членні каблучки, пов'язані між собою слабкими межмолекулярными зв'язками.
Малюнок Молекула сірки
Звідси - низька твердість і висока тендітність цих мінералів.
Метали. Гомоатомные або гетероатомные Сполуки металів із подібною будівлею зовнішніх електронних оболонок характеризуються металевим зв'язком. У металах атоми знаходяться в стані
металевого хімічного зв'язку і відповідно до вимоги організації восьми електронної
конфігурації кожний атом металу з s1 електронною оболонкою знаходиться в 8-ной координації, створюючи
плотнейшую кубічну гранецентрированную элеменарную осередок кристалічної структури, а з s2
оболонкою - гексагональную осередок. Тільки залізо утворить менше щільний об'ємно-центрований кубічний осередок.
Для самородних металів характерні широкі ізоморфні заміщення, іноді з утворенням
проміжних по складі мінералів - сплавів і навіть мінеральних видів з упорядкованою структурою і
розпадом твердих розчинів - сплавів з утворенням орієнтованих вмикань і взаємних
проростів.
Всі самородні метали володіють високої тепло-и електропровідністю, сильним металевим
блиском, дуже високою щільністю (Cu, Ag, Au, Fe, Co, Ni, Hg, Ru, Rh, Pd, Os, Ir, Pt). Більшість
характеризується високою ковкістю і пластичністю, але помірною твердістю (3-4), що залежить від
домішок. cамородный осмий - осмирид отличающийся некоторой ковалентностью, виділяється більш
високою тендітністю, твердістю (до 6) і пругкістю.
Діагностика
Самородні метали визначаються по ковкості, блиску в тому числі у воді, помірно-низької і середньої
твердості, по цвіту і блиску риси. Склад самородного золота, а також золота в переработаном виді
визначається пробностью- ваговим м утриманням металу золота щодо загальної ваги в тясячных
частках. установлені державою проби 335, 500, 575 і 785 при різному утриманні срібла, міді, палладия
й ін. Можна визначати по цвіту, по твердості, по хімічних реакціях, по электро-химической рнакции за
допомогою Голд-детекторов. Для визначення утримання золота в породі, руді, мінералі або сплаві краще
возпользоваться хімічними методами - пробірним аналізом, атомної адсорбції, або методами
нейтронної активації або ренгено-спектрального аналізу.
У металлидах - Сполуких металів, що ставляться до різних груп Періодичної системи елементів,
металеві зв'язки разбавляются полярними зв'язками ковалентного або донорно-акцепторного характеру.
Прикладом можуть служити станниды і плюмбиды металів платинової групи.
Полуметаллы. У полуметаллах із змішаною ковалентно-металлической зв'язком донорно-акцепторного типу
і зростаючого ступеня металличности від миш'яку до сурми й особливо до вісмуту характерна
шарувато-гофрована структура, зроблена спайність, тендітність. Щільність знаходиться в залежності від
атомної маси елемента і досягає р/ см3.
Полуметаллиды. Сполуки металів із полуметаллами забезпечуються донорно-акцепторной зв'язком із
значною участю металевого зв'язку, що зростає зі збільшенням атомного номера полуметалла в
ряду миш'як - сурма - вісмут. Їм відповідають арсениды, стибниды, висмутиды.
Неметаллиды. У Сполуких металів із неметаллами протилежного знака, тобто катионов і аніонів,
тип хімічного зв'язку визначається в основному електронною будівлею аніона. У Сполуких металів
перехідних груп із частково заповненими d - оболонками, більш істотно виявляються
донорно-акцепторные хімічні зв'язки.
Галогениды й оксиди. Сполуки металів із фтором, хлором і киснем здійснюється іонним типом зв'язку. Металевого зв'язку у важких лужних і шляхетних металів. Іонний зв'язок у максимальному ступені виявлений у фторидах і хлоридах лужних металів. У реальних мінералах - Сполуких самих
різноманітних по будівлі хімічних елементів і різних пропорцій і різних сполучень хімічні зв'язки
в основному змішаного типу. Тією ж мірою різноманітні конституційні властивості мінералів.
3. Поширеність, походження, родовище, технічне застосування й економічне значення.
Представники класів самородних металів, полуметаллов і неметаллов немногочисленны (усього
нараховується біля 50 мінеральних видів) і в природі зустрічаються достатньо рідко. За винятком
графіту, самородної сірки і самородної міді вони не утворять значних скупчень.
Походження самородних елементів пов'язано з ендогенними й екзогенними процесами диференціації.
Велика частина їх утвориться в зв'язку з магматичними і постмагматичесчкими процесами.
Діамант знаходять у кимберлитах, лапроитах, дунитах, у метаморфитах, у річкових і морських розсипах. У прибережних і підводних розсипах розсипах Намибии добуваються найкращі діаманти ювелірної якості з утриманням до 60-60 % від загальної маси. У Якутії -переважають прекрасні октаэдрические
кристали, у розсипах Заира кубічні пофарбовані діаманти, в Австралії - рожеві діаманти високої
рідкості і вартості.
Синтез аналогів діаманту й імітацій.
Графить - в основному продукт метаморфізму углеводородного речовини осадових порід.
Самородна сірка має вулканічне (эксгаляционное) походження або утвориться в гипергенных
умовах при участі бактерій, що сульфатредуцируют, за рахунок гіпсу.
Самородне залізо - типовий матеріал метеоритів. Знаменитий чорний камінь КААБА - залізний метеорит. Встановлено утворення плівок самородного заліза на поверхні реголита-лунного грунту в
результаті відновлення заліза силікатів сонячним вітром-потоком електронів - чи не тому
так яскраво відбиває Місяць промені
Лонсдейлит - гексагонаьная полиморфная модифікація вуглецю має також космогенное походження.
Його знаходять у импактитах. Його знаходять у импактитах - гірських породах метеоритных кратерів. Незвичні в
земні умови неметаллиды - карбиды, фосфиды, силициды і нитриды характерні для метеоритів і
виявлені також у грунті Місяці.
Самородна мідь концентрується в значних масах у гидротермальных утвореннях, пов'язаних із
базальтовим магматизмом і зустрічається разом із цеолітами і кальцитом (Мічиган, США, Індія, Тиман).
Утворення самородної міді разом із купритом і малахітом пов'язано з процесами повторного збагачення
в нижніх частинах зони окислювання мідних сульфідних родовищ (Джезказган, Казахстан).
Самородне срібло входить до складу руд так називаної пятиэлементной формації разом із самородним
миш'яком, самородним вісмутом, червоними срібними рудами, уранинитом, скуттерудитом і ін. (Чехія,
Німеччина, Канада). У гидротермальных родовищах срібних руд самородне срібло зустрічається
разом із родонитом (Чукотка, Росія).
Самородне золото -мінерал гидротермальных жил пов'язаних із гранітами, добувається з розсипів,
витягається з руд іншого профілю.
Платина з осмистым иридием утвориться в ультраосновных породах із хромитом, плтина з палладием - у
сульфидно-медно-никелеых родовищах, добувається також із розсипів.
Економіка
Дорогоцінні самородні метали - золото і срібло - і діаманти з найдавніших часів дуже високо
цінувалися, срібло, а потім золото з антчных часів служили грошовою одиницею. Саме серебрянные рудники біля Афін забезпечили її верховенство в Елладі. Сестреции Римської імперії і серебрянники
раннього християнства, серебрянные гривні, рублі і копійки Древньої Русі.. Золото завжди було символом
вищої влади і багатства. Тільки в пізньому середньовіччі після відкриття золота Центральної і південної
Америки золоті монети узвичаїлися. В даний час золото перестало бути грошовою одиницею -
воно еквівалент грошей і є товаром, об'єктом банківських операцій.
Обсяги видобутку. Золото добуваються з розсипів і корінних родовищ при утриманні їх у рудах біля 1 р на тонну і менше. Найважливішим методом збагачення служить гравитация з наступною цианидной
опрацюванням концентрату і на аффинажных заводах стандартних злитків вагою 11 кг. Десять років тому у усьому
світі добувалося біля 1200 т золота, із них 400 тонн добувалося в колишньому СРСР. Зараз добувається 3000
тонн за рахунок освоенния нових технологій бактеріального выщелачивания золота з бідних руд із великими
запасами. Платина добувається в обсягах на порядок менше, срібла набагато більше (воно витрачається в
основному в электро-технике і фотоделе Основні центри видобутку золота це Південна Африка, Австралія,
Росія.. У Росії видобуток в останні роки різко впала і не перевищує 100 тонн. 80 % що добувається золота використовується в даний час у ювелірній справі. Центрів ювелірної справи знаходиться з найдавніших
часів і середньовіччя в Італії. І тільки декілька відсотків в електронній промисловості і
стоматології. Золото в монетах і самородках як колекційний матеріал.
Діаманти і діаманти. Така ж роль і діамантів. З усіх щорічно що добуваються 120 млн. карат діамантів 60-80
% % - это технические алмазы абразивной и металлообрабатывающей индустрии.Інші після огранювання використовуються в ювелірних виробах. Основні центри видобутку діамантів знаходяться в Африці, Австралії і
Росії (20% по обсязі і половина вартості) (5 % ювелірних діамантів). Торгівлю діамантами на 90 % контролює компанія Де Бирс. Опрацювання діамантів у діаманти зосереджені в Бельгії, Ізраїлі, США і
Індії. Споживання ювелірних виробів у США, Японії, Індії, Європі. Річний оборот у усьому світі з діамантами досягає 48 млрд. доларів.
Золото, срібло і платиноиды - дорогоцінні метали разом діамантами й іншими дорогоцінними каменями 1
категорії ставляться Федеральним законом до валютних цінностей. Це значить, що будь-які операції з цими матеріалами без спеціального дозволу не законны. Розвідка, видобуток, переробка, опрацювання, торгівля.
За винятком ювелірних виробів.
Cohenite (Fe, Ni, Co)3C
The Canadian Mineralogist Vol. 39, pp. 889-905 (2001)
 2015-06-24
2015-06-24 771
771






