Каждое ГЛС имеет определенное внешнее оформление: этикетку, которая наклеена непосредственно на упаковку, упаковочный лист, бандероль, инструкцию по медицинскому применению, в которой указан способ применения ГЛС.
Маркировка лекарственных средств в Украине должна соответствовать Закону Украине «О лекарственных средствах», ГСТУ 64-7-2000, и Приложению 9 к пункту 6.1 Порядка проведения экспертизы регистрационных материалов на лекарственные средства, подаваемых на государственную регистрацию (перерегистрацию), а также экспертизы материалов о внесении изменений к регистрационным материалам в течение действия регистрационного удостоверения, утвержденного Приказом №426 МЗ Украины от 26.08.2005 (с изменениями и дополнениями в последней редакции).
К требованиям графического оформления упаковки относятся:
§ информационная функция упаковки должна быть обеспечена четкой и контрастной печатью, возможностью легкого считывания информации;
§ производить эстетическое влияние на потребителя;
§ иметь высокий художественный и технологический уровень обеспечения маркировки.
На вторичной упаковке готового лекарственного средства, а при ее отсутствии – на первичной упаковке указываются такие сведения:
| |||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||
|
| ||||||||||||||||
| |||||||||||||||||
На первичной упаковке в виде блистера, первичной упаковке суппозиториев, тубе и т.п. приводится следующая информация:
 |
На первичной упаковке небольшого размера (ампулы, тюбик-капельницы, шприц-тюбика и т.п.), которая помещается во вторичную упаковку, приводятся такие данные:

Регистрационный номер лекарственных средств, зарегистрированных до августа 2003 г., содержит следующую информацию: буквы "Р" или "П" в зависимости от регистрационной процедуры означают регистрацию или перерегистрацию лекарственного средства соответственно, далее четыре цифры обозначают месяц и год регистрации, после риски пятизначное число показывает порядковый номер регистрации, который вносится в Государственный реестр лекарственных средств Украины.
 |
Согласно Приказу МЗ Украины № 358 от 29 июля 2003 г. регистрационный номер ЛС состоит из буквенного кода Украины "UA", после риски следует четыре цифры порядкового номера ЛС в Государственном реестре, затем по две цифры обозначений каждой новой лекарственной формы и каждой новой силы действия (т.е. каждой новой дозировки) конкретного ЛС. Дата регистрации и номер Приказа МЗ Украины указывается на листке-вкладыше, прилагаемом к ГЛС.

Номер серии ЛС обозначается арабскими цифрами. Слово "серия" не указывается. Последние четыре цифры номера означают месяц и год производства ЛС, цифры перед датой указывают производственный номер серии.
|
Номер серии лекарственного средства должен быть указан на первичной и вторичной упаковке.
Указание номера серии по-английски - Batch. Например:
В. № 020805 (учитывает месяц и год производства);
Ch.- В. 210053 (не учитывает месяц и год производства);
Charge - Nr.: 1530708, №. 0301108 (учитывает месяц и год производства)
В 0615 — месяц и год не учитываются.
В то же время, на упаковках импортных лекарственных препаратов дополнительно наносится дата изготовления (производства).
В английской транскрипции часто используется сокращенный вариант слова “Manufactured “ - “Mfd” - произведено (иногда “Mfg”). В немецкой транскрипции дата изготовления - Herstelldatum. Примеры обозначений даты производства:
Дата произв.: 08/07
MFD 7/08
008 MFD 10.08
Для лекарственных средств, изготовленных одним предприятием (в упаковке "ангро"), а расфасованных другим, указывается номер серии предприятия, которое фасовало лекарственное средство.
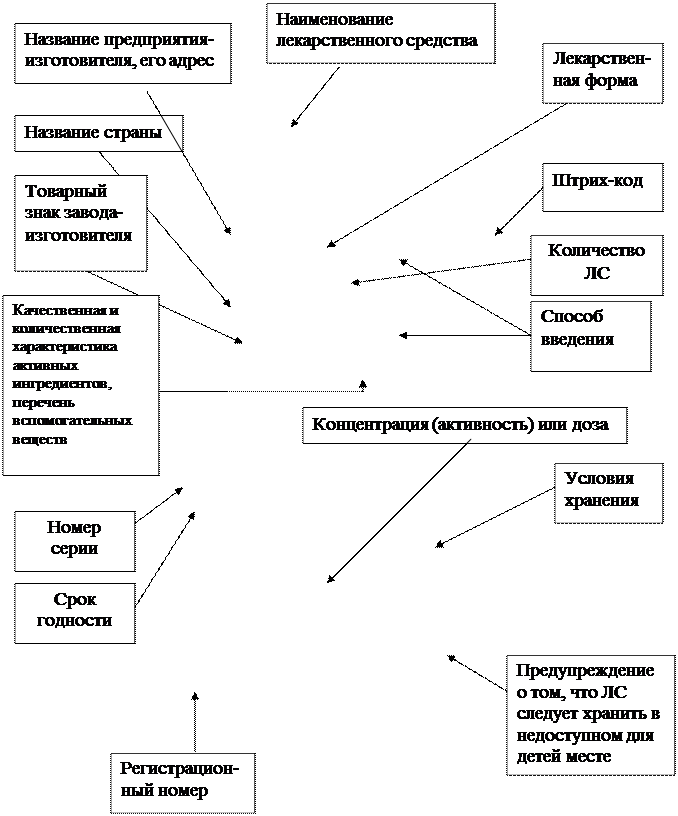

Рисунок 14.2. Графическое оформление вторичной упаковки ГЛС
Срок годности следует указывать: "Годен до..." или (при малых размерах печатного поля) - "до...". Римскими цифрами указывается месяц, арабскими - две последние цифры года. Допускается отмечать месяц арабскими цифрами. Высота цифр должна быть не более 5 мм.
" Годен до X 2001" ("Годен до Х 2001") или "До X 2001" ("До Х 2001") - определяет пригодность до октября 2001 года;
Допускается обозначение "Годен до X 01" ("пригодный до Х 01") или "До Х 01"("До Х 01").
Для лекарственных средств, фасуемых в тубы, допускается обозначение срока годности на тубе.
Например – "Срок годности 2 года".
Для лекарственных средств, в форме капель, при необходимости, следует указывать срок годности лекарственного средства после раскрытия упаковки – "Срок годности после раскрытия... суток".
На упаковке лекарственного растительного сырья необходимо дополнительно указывать требования относительно условий и срока хранения приготовленного настоя.
В случаях маркировки комплекта антибиотика с растворителем, на пачке должен быть указан номер серии антибиотика и номер серии растворителя, а также срок годности лекарственного средства (антибиотика).
Если для лекарственного средства определен ежегодный контроль по показателям качества, то на упаковке указывают "Контролируется ежегодно".
Для лекарственных средств, содержащих сильнодействующие и ядовитые вещества, на потребительской упаковке указывают надпись-предупреждение "Применять по назначению врача".
Условия хранения указываются в соответствии с требованиями, определенными разработчиком лекарственного средства.
Штриховое кодирование, печать и размещение штрих-кодовых пометок на первичной и вторичной упаковке должно быть выполнено в соответствии с требованиями Национальных стандартов Украины и руководящих нормативных документов по штриховому кодированию товарной продукции.
Адрес предприятия-производителя должен быть указан полностью. Допускается не указывать полный адрес предприятия-производителя на первичной упаковке в случаях, если этикетка первичной упаковки имеет малые размеры печатного поля и название предприятия-производителя включает в себя информацию о местонахождении предприятия.
Вторичная упаковка и этикетка групповой тары должны содержать полный адрес предприятия-производителя.
Открытое акционерное общество "Фармак", г. Киев, ул. Фрунзе, 74;
Допускается указывать:
ОАО "Фармак", г. Киев, ул. Фрунзе, 74;
ОАО "Фармак", г. Киев (при малых размерах печатного поля).
Акционерное общество "Киевмедпрепарат",
г. Киев, ул. Саксаганского, 139;
Допускается указывать:
АО "Киевмедпрепарат", г. Киев, ул. Саксаганского, 139.
АО "Киевмедпрепарат", (при малых размерах печатного поля).
Наименование лекарственного средства должно быть указано на украинском (и русском) и латинском (и/ или английском) языках.
Наименование лекарственного средства и международное непатентованное название должны выделяться среди всех других маркировочных надписей. Для этого используется более крупный и (или) жирный шрифт, контрастный цвет, выбирается удобное для прочтения место на этикетке или на одной из граней упаковки. Вокруг названия не должны располагаться надписи, затрудняющие прочтение названия.
С 1 января 2010 г. в силу вступили изменения к Закону Украины «О лекарственных средствах», обязывающий производителей лекарственных препаратов маркировать упаковку шрифтом Брайля, точнее, наносить на упаковку название препарата, дозы действующего вещества и формы лекарства.
Шрифт Брайля является методом передачи информации – то есть дает возможность пользователю прочитать тактильным способом текст, написанный на украинском, русском или другом языке.
Министерство здравоохранения Украины определяет лекарственные средства, упаковка которых не маркируется шрифтом Брайля или шрифтом Брайля указывается только название лекарственного средства.
К каждому реализуемому лекарственному средству, прикладывается инструкция о применении, которая должна содержать:
- наименование лекарственного средства;
- общую характеристику (химическое название, основные физико-химические свойства, состав);
- сведения о фармакологических свойствах;
- показания для применения;
- противопоказания;
- взаимодействие с другими лекарственными средствами;
- способы применения и дозы;
- побочное действие;
- формы выпуска;
- условия и сроки хранения;
- условия отпуска.
 2015-06-28
2015-06-28 6067
6067
