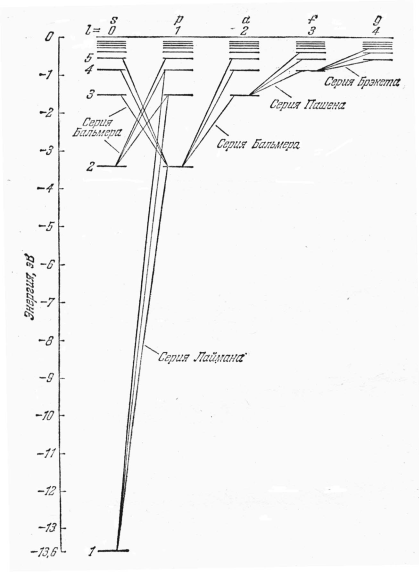
Изучение атомных спектров послужило ключом к познанию строения атомов. Прежде всего, было замечено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы или, как их называют, серии линий. Отчетливее всего это обнаруживается в спектре простейшего атома — водорода. На рис.1 представлена часть спектра атомарного водорода в видимой и близкой ультрафиолетовой области. Символами Нa а, Нb, Нg, Нd, обозначены видимые линии. Н∞ указывает границу серии. Очевидно, что линии располагаются в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.
Швейцарский физик Бальмер (1885) обнаружил, что длины волн этой серии, линий водорода могут быть точно представлены формулой:
Н ∞
Рис. 1 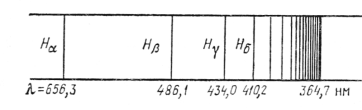
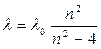 , (1)
, (1)
где l0 — константа, n— целое число, принимающее значения 3, 4, 5 и т.д.
Ecли перейти в (1) от длины волны к частоте, получится формула
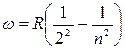 , (2)
, (2)
где R — константа, называемая в честь шведского спектроскописта постоянной Ридберга. Она равна:
R = 2,07 1016 с-1. (3)
Формула (2) называется формулой Бальмера, а соответствующая серия спектральных линий водородного атома — серией Бальмера. Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий.
В ультрафиолетовой части спектра находится серия Лаймана, Остальные серии лежат в инфракрасной области. Линии этих серий могут быть представлены в виде формул, аналогичных (2):
серия Лаймана 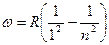 (n=2,3,4….)
(n=2,3,4….)
серияПашена 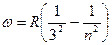 (n=3,4,5….)
(n=3,4,5….)
серия Брэкета 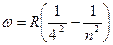 (n=4,5,6….)
(n=4,5,6….)
серия Пфунда 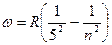 (n=5,6,7….)
(n=5,6,7….)
Частоты всех линий спектра водородного атома можно представить одной формулой:
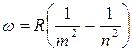 (4)
(4)
где т имеет значение 1 для серии Лаймана, 2 — для серии Бальмера и т. д. При заданном т число п принимает все целочисленные значения, начиная c m+ 1. Выражение (4) называют обобщенной формулой Бальмера.
При возрастании п частота линии в каждой серии стремится к предельному значению R/m2, которое называется границей серии (на рис.1 символом H∞ отмечена граница серии Бальмера).
Возьмем ряд значений выражения Т (п)= R/n2:
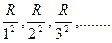 (5).
(5).
Частота любой линии спектра водорода может быть представлена в виде разности двух чисел ряда (5). Эти числа называют спектральными термами или просто термами. Так, например, частота первой линии серии Бальмера равна Т (2) — Т(3), второй линии серии Пфунда Т(о) — Т (7) и т. д. Изучение спектров других атомов показало, что частоты линий и в этом случае могут быть представлены в виде разностей двух термов (комбинационный принцип Ритца):
w= Т1(m)-Т2(n). (6)
Однако терм T(n) обычно имеет более сложный вид, чем для водородного атома. Кроме того, первый и второй члены формулы (6) берутся из различных рядов термов.
Теоретическое обоснование эмпирической формулы Бальмера дает квантовомеханический подход. В рамках данного подхода для атома водорода записывается уравнение Шредингера:
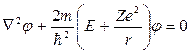 (7)
(7)
Далее ищутся решения данного уравнения на собственные значения. Уравнение (7) имеет однозначные, непрерывные, конечные решения при дискретных отрицательных значениях энергии Е:
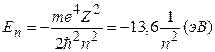 (n= 1, 2, 3, 4, …….) (8)
(n= 1, 2, 3, 4, …….) (8)
Число n фигурирующее в формуле (8) называется главным квантовым числом.
Сравнивая (8) с бальмеровским видом записи спектральных термов приходим к выводу, что совокупность спектральных термов отображает закон квантования энергетического спектра атома водорода, а постоянная Ридберга для атома водорода может быть представлена в виде:
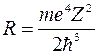 (9).
(9).
 2015-06-28
2015-06-28 448
448







