Биологическая роль витаминов определяется их каталитическим, некоферментным и антимутагенным действием. Многие витамины (практически все витамины группы В) входят в состав коферментов различных ферментов, например, витамин В2 – в состав коферментов ФАД, ФМН, витамин В5 – в состав НАД и НАДФ, витамин В3 – в состав КоА и т. д.
Некоферментные функции витаминов заключаются в участии их в регуляции синтеза нуклеиновых кислот, белков, в формировании структуры клеточных мембран. Важное значение имеет антимутагенное действие витаминов С, Е (α-токоферола) и β-каротина (провитамина А). Эти витамины могут нивелировать как спонтанные мутации, так и мутации, индуцированные ионизирующими излучениями и канцерогенами.
В природе источником витаминов являются главным образом растения и микроорганизмы. Животные получают витамины с пищей, а также в результате жизнедеятельности микроорганизмов кишечника. Организм человека многих витаминов не синтезирует.
Мировой рынок витаминов составляет более 70 тыс. т в год. Около 50% от общего объема производства составляет витамин С. Ведущее место в производстве витаминов занимает швейцарский концерн «Hoffman La Roche», на долю которого приходится 50–70% от общего объема производства витаминов.
Большая часть витаминов производится химическим синтезом. Микробиологическим путем получают витамины В2, В12, D2, С (стадия биотрансформации D-сорбита в L-сорбозу), β-каротин.
12.1. Технология кормового препарата витамина В12
Витамин В12 имеет самое сложное строение среди неполимерных соединений. Молекула витамина включает корриновое кольцо из четырех пятичленных азотсодержащих гетероциклов, связанных с атомом кобальта четырьмя координационными связями. Все разнообразие аналогов витамина В12 обусловлено природой верхнего и нижнего лигандов атома кобальта. В истинном витамине В12 (цианкобаламине) верхним лигандом является цианогруппа. Ее место могут занимать другие заместители: группа -ОН – оксикобаламин, -СН3 – метилкобаламин, 5-дезоксиаденозил – аденозилкобаламин и др. При этом образуются производные витамина, обладающие биологической активностью для животных и человека.
Нижним лигандом атома кобальта в молекуле витамина В12 является специфическое азотистое основание – 5,6-диметилбензимидазол (5,6-ДМБ), которое в природе встречается только в этом соединении. Непосредственным предшественником 5,6-ДМБ является рибофлавин. Наличие 5,6-ДМБ определяет биологическую активность корриноидов. Микроорганизмы могут синтезировать производные витамина, содержащие в качестве нижнего лиганда другие заместители: 5-оксибензимидазол (производное имеет название фактор III), 5-метоксибензимидазол (фактор IIIm), метиладенин (фактор А), аденин (псевдовитамин В12). Нижний лиганд может отсутствовать (фактор В). Биологической активностью обладают лишь формы, содержащие в качестве нижнего лиганда 5,6-ДМБ. В меньшей степени биологически активны фактор III и фактор IIIm. Псевдовитамин В12 и фактор А активностью не обладают.
Промышленным способом получения витамина В12 является микробиологический синтез (химический синтез осуществлен, но отличается большой сложностью). В природе корриноиды обнаруживают в растениях, развивающихся в симбиозе с азотфиксирующими бактериями. Происхождение этих корриноидов окончательно не установлено. Организм животных и человека не способен к самостоятельному синтезу витамина В12. Не образуют корриноиды дрожжи и мицелиальные грибы. Способность к биосинтезу корриноидов широко распространена среди прокариот.
Путь биосинтеза витамина В12 известен. Общим интермедиатом на начальном этапе биосинтеза корриноидов является аминолевулиновая кислота, которая образуется у большинства микроорганизмов в результате конденсации глицина и янтарной кислоты в виде сукцинил-КоА.
Препараты витамина В12 широко применяются в медицине (лечение лучевой болезни, злокачественного малокровия, болезни Боткина, дистрофии, язвы желудка и т. д.), а также для обогащения кормов (улучшают усвоение белка и повышают прирост массы животных на 10–15%).
Мировое производство витамина В12 составляет около 10 т в год, из которых 6,5 т – на медицинские цели. В промышленном производстве в качестве продуцентов витамина В12 используют пропионовокислые бактерии (Propionibacterium shermanii), актиномицеты (Nocardia rugosa), термофильные (реже мезофильные) метаногенные бактерии.
Кормовой препарат витамина В12 для нужд животноводства получают термофильным метановым сбраживанием жидких отходов микробиологического производства органических растворителей – ацетоно-бутиловой и спиртовой барды, содержащей сухих веществ 2,2–2,6% и 6,0–8,0% соответственно. В состав сухих веществ барды входят белки, аминокислоты, углеводы, летучие жирные кислоты, витамины, неорганические соединения.
Для метанового брожения применяют декантат ацетоно-бутиловой барды (рис. 12.1). Осадок взвешенных веществ, содержащий мертвые клетки продуцентов ацетона и бутанола, используют в качестве кормовой добавки. Декантированную барду охлаждают со снижением температуры от 100 до 55–57°С (температура метанового сбраживания). Выход корриноидов значительно увеличивается при добавлении к барде метанола (5 кг/м3) и хлорида кобальта (5 г/м3). Непрерывное сбраживание барды осуществляют в железобетонных метантенках объемом 2000–4000 м3 по одно- или двухступенчатому режиму. При термофильном метановом брожении в анаэробных условиях развивается биоценоз бактерий, осуществляющих сложный взаимосвязанный процесс расщепления органических веществ до СО2 и СН4. Можно выделить четыре основные группы бактерий: гидролизующие (расщепляют биополимеры), углеводсбраживающие, сульфатвосстанавливающие и метанобразующие.
В первой фазе процесса развиваются бактерии-аммонификаторы (разлагают белки, пептиды, аминокислоты до жирных кислот и аммиака) и бродильщики. В результате образования аммиака и нейтрализации жирных кислот рН ферментационной среды повышается до 7,0–7,5. Наступает вторая фаза брожения, в которой интенсивно развиваются сульфатвосстанавливающие и метанобразующие бактерии.
В производственных условиях метановое брожение целесообразно осуществлять в двух последовательно соединенных метантенках (по двухступенчатому режиму), что приводит к специализации бактерий, развивающихся в аппаратах первой и второй ступеней, в соответствии с фазами брожения и сокращению продолжительности процесса с 3,0–3,5 сут (сбраживание в одну ступень) до 2,5–3,0 сут (две ступени сбраживания). Процесс метанового брожения протекает устойчиво и не нуждается в условиях асептики.
В сброженном растворе накапливается 4–5 г/м3 корриноидов, из которых в среднем 50% приходится на истинный витамин В12, 30% – на фактор III. Установлено, что группа метанобразующих бактерий синтезирует около 75% витамина В12 от общего количества.

Рис. 12.1. Технологическая схема получения кормового концентрата витамина В12 из послеспиртовой барды:
1 – сборник барды; 2 – поверхностный конденсатор; 3 – декантатор; 4 – сборник декантата; 5 – теплообменник;
6 – анаэробный реактор; 7 – стабилизатор бражки; 8 – теплообменник; 9 – газоотделитель; 10 – газгольдер
Видовая принадлежность анаэробных бактерий, продуцирующих витамин В12, окончательно не установлена. Подтверждена продукция корриноидов метанобразующими бактериями Methanosarcina barkeri, Methanobacterium formicum.
Установлено, что кокковые формы, составляющие 8–10% от всех бактерий, синтезируют примерно 65% корриноидов, а палочки (90–92%) продуцируют остальные 35% корриноидов.
В процессе брожения образуется биогаз (в среднем 20 м3 на 1 м3 жидкой среды), имеющий следующий усредненный состав (%): СН4 – 65, СО2 – 30, Н2 и Н2S – 5.
Сброженная барда имеет величину рН 7,5–8,0. В щелочной среде витамин В12 неустойчив, поэтому для стабилизации витамина метановую бражку подкисляют до рН 5,5–6,0 и вводят 0,2–0,3% сульфита натрия. Перед подачей на упаривание для обеспечения безопасности процесса бражку подвергают дегазации нагреванием в теплообменнике до 90–95°С с последующим отделением газов в объемном сепараторе. Дегазированную бражку сгущают до 20% сухих веществ упариванием в трех- или четырехкорпусных вакуум-выпарных установках. Концентрат высушивают в распылительной сушилке при температуре теплоносителя на входе в сушилку 280°С. Продукт – кормовой препарат витамина – представляет собой порошок коричневого цвета и содержит витамин В12 в количестве не менее 100 мг/кг, а также сырой протеин – не менее 25%.
Витамин В12 для медицинских целей получают культивированием бактерий Propionibacterium shermanii периодическим методом при температуре 28–30°С в анаэробных условиях с соблюдением правил асептики на питательной среде, содержащей глюкозу (40 г/л), кукурузный экстракт (40 г/л), сульфат аммония (2 г/л) и хлорид кобальта (0,005 г/л); рН среды 6,8–7,0. Ферментация протекает в две фазы. В первой фазе продолжительностью 65–70 ч бактерии интенсивно размножаются с накоплением пропионовой и уксусной кислот, подлежащих нейтрализации, и предшественника витамина В12 – фактора В (без нижнего лиганда). На долю фактора В приходится более 80% от всех синтезированных корриноидов (остальное – цианкобаламин (8–10%), псевдовитамин В12 и фактор А).
Вторая фаза ферментации начитается с момента внесения в среду 5,6-ДМБ в количестве 10–20 г/м3, в результате чего происходит трансформация неактивных аналогов в истинный витамин В12. Продолжительность второй фазы 24 ч. К концу процесса культуральная жидкость содержит около 30 мг/л витамина В12, накопленного в клетках бактерий.
Биомассу отделяют сепарацией и экстрагируют из нее витамин водой, подкисленной до рН 4,5–5,0, при температуре 85–90°С в течение часа. После отделения остатка биомассы раствор охлаждают, доводят рН до 6,8–7,0 и осаждают белки коагуляцией в присутствии Al2(SO4)3 или FeCl3. Осадок отделяют фильтрованием, а раствор витамина очищают на ионообменной смоле СГ-1, с которой витамин В12 элюируют водным раствором аммиака. Элюат упаривают и дополнительно очищают на колонке с окисью алюминия (очистка кобаламинов от аналогов). Элюируют витамин В12 водным ацетоном и кристаллизуют из раствора при температуре 3–4°С в течение 24–48 ч. Кристаллы промывают ацетоном, затем диэтиловым эфиром и сушат под вакуумом.
12.2. Технология кормового препарата витамина В2
Витамин В2 (рибофлавин) в промышленных условиях производят для кормовых целей. Продуцентами рибофлавина в природе являются высшие растения, дрожжи, мицелиальные грибы и бактерии. Большинство микроорганизмов образуют свободный рибофлавин и две его коферментные формы – ФМН и ФАД. Основной формой флавинов, синтезируемых микроорганизмами, является рибофлавин. Гетероциклическая система рибофлавина представлена тремя конденсированными циклами: ароматическим (А), пиразиновым (В) и пиримидиновым (С). К пиразиновому кольцу присоединен спирт рибит:
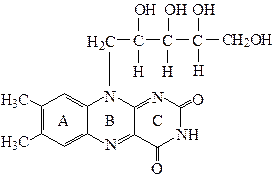
Рибофлавин – светочувствительное оранжево-желтое красящее вещество. Водные растворы рибофлавина флуоресцируют на свету, давая желто-зеленое окрашивание. Флуоресцирующая способность витамина используется при его количественном определении. Окислительно-восстановительные свойства флавинов обусловлены наличием в составе молекулы системы, способной к обратимому окислению и восстановлению:
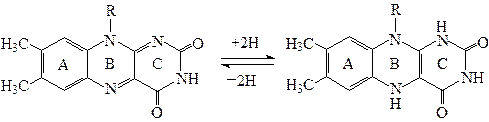
С этим связана биологическая роль витамина В2, которую в клетках выполняют моно- и динуклеотидные формы рибофлавина.
Путь синтеза рибофлавина в микробных клетках установлен. Предшественником рибофлавина является гуанозинтрифосфат.
Микроорганизмы, как правило, синтезируют рибофлавин в больших количествах, чем необходимо для удовлетворения потребности клетки. Например, дрожжеподобные грибы синтезируют до 6 г/дм3 рибофлавина, в то время как потребность в нем не превышает 0,1 мг/дм3. Высокой рибофлавинпродуцирующей способностью отличаются дрожжеподобные грибы Eremothecium ashbyii (до 2,5 г/дм3 витамина В2) и Ashbya gossypii (до 6 г/дм3), применяемые в промышленном производстве витамина В2.
Для большинства микроорганизмов выход рибофлавина увеличивается при дефиците железа в среде. Предполагают, что ионы железа участвуют в регуляции синтеза рибофлавина. Однако для штаммов-сверхсинтетиков E. ashbyii и A. gossypii дефицит железа не влияет на рибофлавинсинтетическую активность. Считают, что указанные продуценты рибофлавина являются природными мутантами с нарушенной регуляцией синтеза витамина.
Получены мутантные штаммы бактерий Bacillus subtilis, способные синтезировать витамин В2 в количестве до 6 г/дм3. В отечественной практике используют гриб Eremothecium ashbyii. Колонии гриба имеют оранжевый цвет. Интенсивность окраски колоний коррелирует с рибофлавинсинтетической способностью. Недостаток культуры – нестабильность при хранении. Гриб легко теряет способность к сверхсинтезу витамина, поэтому осуществляют систематический отбор наиболее интенсивно окрашенных колоний. Культура A. gossypii (применяется за рубежом) более стабильна, хорошо развивается, используя в качестве источника углерода углеводы (глюкозу, сахарозу), но лучше всего – соевое и кукурузное масло.
Рибофлавин накапливается в мицелии в виде желтых кристаллов, к концу ферментации около 80% рибофлавина выходит из клеток в результате автолиза.
Гриб E. ashbyii образует на дрожжевой агаризованной среде (дрожжевой экстракт 0,2–0,4%, пептон 0,3%, глюкоза 1%) после шести дней роста ярко-оранжевые колонии диаметром 5–8 мм. На соевой агаризованной среде (мука соевая 4,0%, сахароза 2,0%) колонии гриба имеют диаметр 17–25 мм. Для получения посевного материала отбирают типичные колонии с интенсивной окраской. В качестве субстрата для получения спорового материала используют подготовленное пшено высшего качества. Флаконы со стерильным пшеном засевают суспензией (смыв культуры с агаризованной среды) и инкубируют при температуре 30°С в течение 8–9 сут. Пшено после прорастания гриба приобретает ярко-желтый цвет. Полученный посевной материал хранят в темноте при комнатной температуре.
Материалом из флакона засевают качалочные колбы и выращивают культуру 10–14 ч. В качалочных колбах и посевных аппаратах используется среда, содержащая кукурузный экстракт 2%, сахарозу 1%, фосфат калия 0,1% и технический жир 0,5%. Величина рН среды 6,8–7,2. Продолжительность ферментации в посевных аппаратах 24–27 ч при температуре 28–32°С и уровне аэрации 50–60 м3/(м3·ч).
Среда для производственной ферментации содержит соевую муку, кукурузный экстракт, мел, технический жир. В первые сутки культивирования гриб накапливает биомассу, а затем переходит к спорообразованию. В этот период интенсивно синтезируется рибофлавин. Примерно с 60-го часа ферментации начинается автолиз культуры и переход рибофлавина в среду. Продолжительность ферментации 65–68 ч, процесс проводят в условиях асептики.
Культуральную жидкость стабилизируют подкислением до значения рН 4,5–5,0, упаривают под вакуумом до содержания сухого вещества 18–20%, концентрат высушивают распылением в мягких условиях (температура сушильного агента на входе в сушилку 150–160°С). Продукт содержит 20–40 г витамина на 1 кг препарата.
Примерно 70% рибофлавина, произведенного в мире, получают путем химического синтеза из рибозы.
 2015-06-26
2015-06-26 9399
9399







