Если эффектор реагирует с группировками аллостерического центра фермента, провоцируя конформационные изменения в этом участке, что естественно сказывается на пространственной укладке активного центра (ведь это единая полипептидная мицелла). Сдвиги в архитектуре последнего сказываются на комплементарности его к субстрату, повышая или наоборот – понижая его сродство. Такие ферменты называют аллостерическими. Подобные биокатализаторы играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки, что имеет большое значение в следующих ситуациях:
· при необходимости ускорения генерации продукта начальные метаболиты будут выступать в качестве активаторов, действуя через аллостерический центр;
· для координации путей синтеза и распада. АТФ и АДФ - аллостерические эффекторы, выступающие как антагонисты;
· для корректировки параллельно протекающих и взаимосвязанных метаболических путей: конечные продукты одного биохимического процесса могут быть аллостерическими эффекторами другого;
· в центральных биохимических процессах субстраты или конечные продукты часто служат аллостерическими регуляторами ферментов их заключительных этапов:
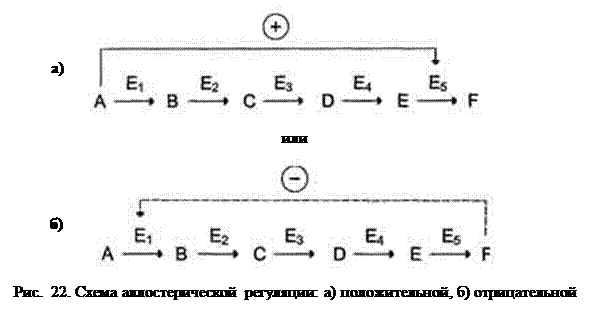
Такой вариант (Рис. 22, а) носит название гомотропного (если эффектор и субстрат - одно и то же вещество). Эти энзимы имеют несколько центров связывания для субстрата, которые могут выполнять две функции: каталитическую и регуляторную. Аллостерические ферменты подобного типа используются в ситуации, когда исходное вещество накапливается в избытке и должно быстро преобразоваться в продукт.
Фермент (Е1), катализирующий превращение субстрата А в продукт В (рис. 22, б), имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F (рис. 22, б). Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такой механизм называют отрицательной обратной связью, или ретроингибированием. Оно часто используется для регуляции обменных процессов в клетке. Логичность его не вызывает сомнений, так как накопившийся конечный продукт, взаимодействуя с аллостерическим центром фермента Е1, подавляет самое начало данного метаболического пути.
· Аллостерические ферменты катализируют ключевые реакции различных биохимических процессов.
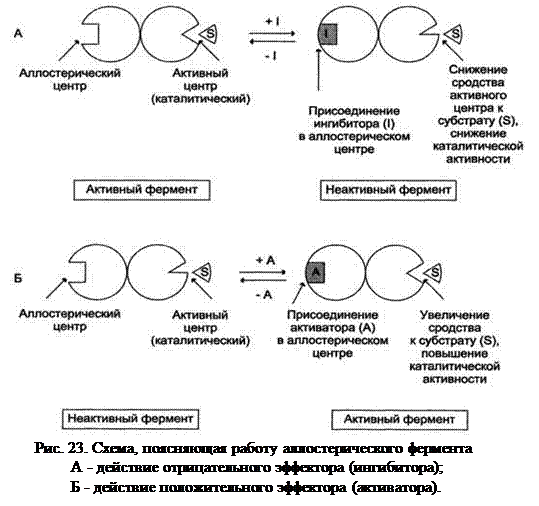
· Обычно это - олигомерные белки, состоящие из нескольких протомеров (Рис. 23. А или Б) или имеющие доменное строение.
· В их молекулах обязательно выделяют аллостерический центр, пространственно удалённый от каталитического.
· Эффекторы нековалентно присоединяются к аллостерическим (регуляторным) центрам фермента (обратимость действия).
· Функциональные локусы энзима могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной или групповой.
· Подобные биокатализаторы обладают свойством кооперативности: взаимодействие эффектора с их аллостерическим центром вызывает последовательные сдвиги в конформации всех субъединиц, приводящие к пространственным перестройкам активного центра, изменению его сродства к субстрату, что сказывается на активности фермента (рис. 23).
· Регуляция аллостерических энзимов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходные свойства биокатализатора.
 2015-06-26
2015-06-26 3016
3016








