Известно, что любое вещество в зависимости от давления и температуры может находиться в различных агрегатных состояниях (твердой, жидкой и газообразной фазах). Типовая диаграмма состояний в координатах р и Т представлена на рис. 15. Кривыми линиями изображены границы между различными фазами (кривые равновесия фаз), соответствующие давлениям и температурам, при которых из одной фазы в другую переходит одинаковое число молекул. 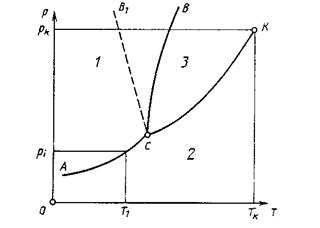
Рис. 15. Типовая диаграмма состояний
При этом кривая СК выражает зависимость от температуры давления насыщенного пара над жидкостью; кривая АС - давления насыщенного пара над твердым телом, кривая ВС - температуры плавления от давления. Например, при давлении р 1и температуре Т1, будет наблюдаться равновесие твердой 1 и газообразной 2 фаз. Если при той же температуре Т1, давление понизить, то начнется переход твердой фазы в газообразную. Этот процесс называется возгонкой или сублимацией („сублимаре" — возносить). Аналогично на границе ВС происходит плавление твердой фазы (кристаллизация жидкой фазы 3), а на границе СК - кипение жидкой фазы (конденсация газообразной фазы). Необходимо отметить также две особые точки.
Тройная точка С, находящаяся на пересечении всех трех кривых равновесия фаз, характеризует состояние вещества, когда находятся в равновесии одновременно твердая, жидкая и газообразная фазы. Критическая точка К соответствует критической температуре Тк и
 критическому давлению рк, при которых теряется всякое различие между жидкостью и ее паром, а граница между ними исчезает.
критическому давлению рк, при которых теряется всякое различие между жидкостью и ее паром, а граница между ними исчезает.
Указанные выше кривые равновесия фаз и тройная точка используются в косвенных методах определения давления по результатам измерения температуры в равновесных точках (в области температурных измерений, наоборот, температура определяется по результатам измерения давления).
Диаграмма состояний дает наглядное представление о выборе того или иного фазового перехода в зависимости от определяемого давления. Кривая плавления ВС немного отклоняется от вертикали к оси абсцисс, т. е. температура плавления имеет небольшую чувствительность к давлению. Так, температура плавления льда изменяется на 1 К при изменении давления на 13 МПа (следует отметить, что в отличие от большинства веществ температура плавления льда понижается при повышении давления - штриховая линия СВ на рис.15), Поэтому кривые плавления используются в косвенных методах определения высоких и сверхвысоких давлений. Процесс сублимации (кривая АС) происходит, как правило, при низких температурах и давлениях, что позволяет его использовать при определении давления в области
вакуумных измерений. И, наконец, фазовый переход жидкость—пар (кривая СК) наиболее удобен для области средних давлений помимо указанного, пои выборе того или иного фазового перехода необходимо учитывать физические свойства применяемого вещества.
В области измерения высоких и сверхвысоких давлений его значение воспроизводится по кривой плавления ртути, полуэмпирическое уравнение которой получают по результатам исследований сравнением с эталонным поршневым манометром. Это позволяет построить непрерывную шкалу давлений, по которой градуируются средства измерений высоких и сверхвысоких давлений низшей точности.
В области средних давлений, где успешно применяются высокоточные средства измерений, основанные на прямых методах, использование косвенных методов нецелесообразно. Однако представляет интерес, получивший распространение в первой половине нашего века простой способ измерения атмосферного давления, основанный на фазовых переходах „жидкость—пар" (кривая СК на рис. 15), который легко может быть продемонстрирован в любой, даже школьной, лаборатории.
 2015-07-02
2015-07-02 498
498








