Олово (Sn) имеет атомный вес 118.69, его содержание в земной коре невелико и составляет около 0.008 вес.%. В свободном состоянии олово является серебристо-белым мягким металлом плотностью 7.28 г/см3; имеющим температуру плавления 231.9ºС.
Олово является одним из наиболее ценных цветных металлов в связи с низким содержанием в земной коре и трудностями, связанными с излечением металла из рудного сырья.
Как полезное ископаемое, олово встречается в виде самородков (оловянный камень).
Олово используется для производства кабельной продукции и припоев. Припоем называется металлический сплав, которым соединяют проводники и выводы радиодеталей ПЭВМ. Чистое олово является самым хорошим припоем, однако по причине дороговизны используется только в исключительных случаях.
При монтаж наибольшее распространение получили легкоплавкие припои, как, например, ПОС-61, ПОС-40 и другие, представляющие собой сплав олова и свинца. Буквы в обозначении марки припоя указывают следующее: П – припой, О – оловянный, С – свинцовый. Цифры обозначают массовое содержание олова в припое (в процентном отношении) [3.8.].
Например, в припое ПОС-18 содержится 18 % олова (остальная часть – свинец).
Для получения особых свойств в состав оловянно-свинцовых припоев вводят кадмий, висмут, сурьму и другие металлы.
Например, припой ПОСК-50-18 – припой оловянно-свинцовый с добавлением кадмия (50 % олова, 18 % кадмия, остальное – свинец), имеющий температуру плавления 145ºС.
Наиболее часто применяется припой ПОС-61, имеющий температуру плавления 190ºС, реже – ПОС-40 с температурой плавления 235ºС.
В настоящее время промышленное применение имеют следующие способы регенерации олова [3.2., 3.4.]: хлорный способ и регенерация с применением щелочных растворов (гидрометаллургия и электрометаллургия).
Рассмотрим регенерацию олова хлорным способом.
В основе этого способа лежит взаимодействие металлического олова с газообразным хлором с получением тетрахлорида олова SnCl4:
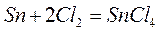 (1)
(1)
Тетрахлорид олова представляет собой бесцветную жидкость, дымящуюся на воздухе, имеющую плотность 2.229 г/см3 при температуре 50ºС, температуру плавления 33ºС, температуру кипения 144ºС.
Изменение энергии Гиббса реакции взаимодействия твердого олова с газообразным хлором определяется уравнением:
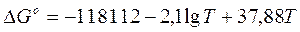 (2)
(2)
Которое свидетельствует об однозначном протекании реакции в сторону обращения хлорного олова.
Тетрахлорид олова взаимодействует с металлическим оловом с образованием хлорного олова:
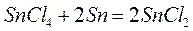 (3)
(3)
Металлическое олово получают:
· из тетрахлорида олова SnCl4;
· цементацией более электроотрицательным металлом, например алюминием Al, цинком Zn, железом Fe либо электролизом с нерастваримым анодом.
При этом олово имеет следующий процентный состав:
99.5 – 99.8 % Sn
0.1 – 0.25 % Pb
следы Al, Zn, Fe
К недостаткам описанного процесса можно отнести использование токсического хлора, воздействующего на слизистые оболочки, верхние и глубокие дыхательные пути человека, а также громоздкость оборудования. Вот почему возникает необходимость устройств очистки выбросов от токсичных газов и применение, по возможности, других мер безопасности.
 2015-07-21
2015-07-21 1058
1058
