С развитием науки элементов открывали все больше и больше, причем некоторые
из них имели сходные свойства. Появилась необходимость упорядочить,
классифицировать их, т. к. это позволило бы более основательно изучать
свойства элементов и их соединений. Вначале попытались классифицировать
элементы, положив в основу их химические и физ. свойства. Однако эти попытки
не привели к желаемым результатам. Правильно подошел к этому вопросу Д. И.
Менделеев. Он обратил внимание, что атомный вес объединяет и связывает
отдельные элементы между собой, и положил его в основу классификации.
Располагая известные в то время элементы в порядке возрастания атомных весов,
Д. И. Менделеев обнаружил, что свойства элементов периодически повторяются. В
1869 г. он сформулировал свой закон:
Свойства простых веществ, а также формы и свойства соединений химических
элементов находятся в периодической зависимости от величины их атомных весов.
В 1913 г. английский ученый Мозли открыл, что важнейшей характеристикой
химического элемента является не атомная масса, а заряд ядра, который
совпадает с порядковым номером. Поэтому в настоящее время закон формулируется
так:
Свойства простых веществ, а также формы и свойства соединений элементов
находятся в периодической зависимости от зарядов их атомных ядер.
Графическим изображением периодического закона является периодическая
таблица. Формы такого изображения различны: их насчитывается около 500,
однако подход к построению таблиц единый - элементы располагаются в порядке
возрастания заряда их атомных ядер.
Периодом в периодической системе называется последовательный ряд
элементов, электронная конфигурация ВЭУ которых изменяется от ns1 до
ns2np6. При этом номер периода совпадает со значением
главного квантового числа n ВЭУ. Каждый из периодов (кроме 1) начинается
типичным металлом и заканчивается благородным газом, которому предшествует
неметалл.
В вертикальных колонках, называемых группами объединены элементы,
имеющие сходное электронное строение. Каждая группа состоит из главной и
побочной подгрупп. Элементы, расположенные в одной подгруппе,
называются аналогами и имеют сходные строения ВЭУ при разных
значениях n и поэтому проявляют сходные химические свойства. Элементы главных и
побочных подгрупп различаются своими химическими свойствами, но их объединяет
номер группы. Он, как правило, указывает число электронов, участвующих в
образовании химических связей. У элементов главных подгрупп валентными
являются только электроны ВЭУ, а у элементов побочных подгрупп – и электроны
предвнешних уровней. Это основное различие между элементами гл. и побочных
подгрупп.
Периодически изменяются радиусы атомов, энергия ионизации, сродство к
электрону и электроотрицательность:
1.Радиус: 2.Еион: 3.Еср
4.Электроотрицательность:

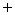
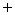
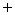

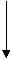

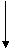
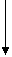

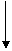

| |||||||

| 
| ||||||

| |||||||
Периодический закон сыграл большую роль в развитии химии. Он помог установить
взаимную связь между элементами и объединить их по свойствам, расположить
элементы в естественной последовательности, исправить и уточнить атомные
массы, предсказать существование новых элементов.
Периодическая система помогает определить состав и формулы химических
соединений. Она является выражением общего закона природы – закона развития в
неорганическом мире.
Периодический закон – величайшее открытие человечества!
 2015-07-14
2015-07-14 505
505








