Первый типический элемент VI группы – кислород – самый распространённый
элемент на Земле: его содержание составляет почти 50 массовых долей, %. А по
ОЭО кислород стоит на втором месте после фтора и поэтому образует огромное
число соединений с другими элементами периодической системы.
Известно более 1400 минералов, содержащих кислород. Важнейшие
кислородсодержащие минералы – кварц и его модификации, полевые шпаты, слюды,
глины, известняки. Огромное количество кислорода находится в воде как в
химически связанном, так и в растворённом состоянии. В свободном состоянии
кислород находится в атмосфере (около 1015 т). Кислород воздуха расходуется
в процессах горения, гниения, ржавления, дыхания и непрерывно регенерируется
за счёт фотосинтеза. Кроме того, кислород является обязательной составной
составной частью организмов животных и растений. Так, в человеческом теле
содержится до 65 массовых долей, % кислорода.
В технике кислород получают фракционированной перегонкой жидкого воздуха и
электролизом воды (как побочный продукт при получении водорода), а в
лаборатории при термическом распаде оксидов (CrO3), пероксидов (BaO
2), солей оксокислот (KNO3, KCIO3, KMnO4
).
Кислород – газ без запаха и цвета. Вследствие плохой деформируемости электронной
оболочки кислород имеет низкие температуры плавления (-118,8ºС) и кипения
(-182,9ºС). Жидкий кислород светло-голубого цвета, а твёрдый – кристаллы
синего цвета. Во всех агрегатных состояниях кислород парамагнитен. Он мало
растворим в воде: в 100 объемах воды при 20ºС растворяется 3 объёма
кислорода. Но эта небольшая растворимость имеет огромное значение для
жизнедеятельности живущих в воде организмов.
Под действием УФ-излучения легко происходит фотолиз молекул кислорода, поэтому
на высоте более 100 км от поверхности земли основной формой существования
кислорода является атомарный. Аллотропной модификацией кислорода является озон
О3. В химическом строении молекулы озона центральный атом кислорода
подвергается sp ²-гибридизации, а его 2 p z
-орбиталь с такими же орбиталями крайних атомов кислорода образует π
р-р –связи вдоль всей молекулы:
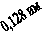



 О
О
120˚
О О
Озон – газ синего цвета, молекулы которого диамагнитны. Цвет его обусловлен
большой полярностью и поляризуемостью молекулы О3 по сравнению с
кислородом.
Озон получается при действии тихого электрического разряда на кислород (до 10
массовых долей, % О3). В атмосфере озон образуется при грозовых
разрядах и в верхних слоях под действием УФ–излучения. Озон сильно
реакционноспособен. Его окислительные свойства выражены несравненно сильнее,
чем у кислорода.
По химической активности кислород уступает только фтору. С большинством простых
веществ он реагирует непосредственно, за исключением галогенов, благородных
газов, платины и золота. Два неспаренных электрона в невозбужденном состоянии
атома кислорода определяют его двухвалентность. Однако максимальная
ковалентность его равна 4. Атом кислорода может находится в sp–, sp2
–, sp3– гибридном состоянии.
1. O2 + H2 → H2O
2. O2 + F2 → O2F2
3. O2 + S → SO2
4. O2 + N2 → 2NO (t>1200˚)
5. 4P + 3O2 → P4O6
6. O2 + C → CO2
7. O2 + 2Mg → 2MgO
Кислород применяется в металлургической и химической промышленности: доменный
процесс, производство азотной и серной кислот. Кроме того, он используется
для подземной газификации углей, газовой сварки и резки металлов. Замена
воздуха кислородом в ряде производств ведет к интенсификации и сокращает
производственный цикл. Смеси жидкого кислорода с горючими материалами (
угольный порошок, опилки, масла и др,) составляют основу мощных взрывчатых
веществ – оксиликвитов, применяющихся при взрывных работах. Кроме того,
жидкий кислород – окислитель для ракетных топлив и хладагент. Наконец,
кислород используется для жизнеобеспечения на подводных лодках и космических
кораблях, а также в медицине.
 2015-07-14
2015-07-14 612
612








